
【题目】某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)可用于制备FeSO4,其流程如下:
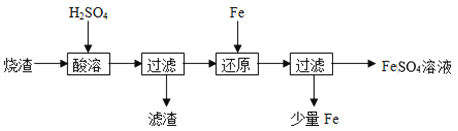
(1)“酸溶”时,提高反应速率的措施有__________(写一条)。
(2)加入Fe粉还原后,检验Fe3+是否反应完全的试剂为_____。
(3)写出“还原”步骤中,Fe粉和Fe3+反应的离子方程式:_________。
【答案】适当加热升温等 KSCN溶液 2Fe3+ + Fe = 3Fe2+
【解析】
烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)用硫酸浸取,过滤后滤液中含有硫酸铁、硫酸亚铁、未反应的硫酸,滤渣为二氧化硅,用铁还原Fe3+后过滤,得滤液中含有硫酸亚铁,据此分析解答。
(1)要提高反应速率,可以通过加热、增加硫酸的浓度、固体粉碎及搅拌等措施,故答案为:加热(或增加硫酸的浓度或将烧渣粉碎或搅拌);
(2)Fe3+与KSCN溶液反应呈血红色,检验Fe3+是否反应完全可选择KSCN溶液,具体方法是取少量溶液,滴入几滴KSCN溶液,若溶液变为血红色,说明其中含有Fe3+,反应未完全,若溶液无明显现象,说明反应完全,故答案为:KSCN溶液;
(3)“还原”步骤中,Fe粉和Fe3+反应的离子方程式为2Fe3+ + Fe = 3Fe2+,故答案为:2Fe3+ + Fe = 3Fe2+。


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
【题目】S2C12是广泛用于橡胶工业的硫化剂,常温下,S2C12是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。S2Cl2的结构与H2O2类似,如下图所示,下列说法正确的是

A. S2C12分子中的两个S原子均是sp杂化
B. S2Br2 与 S2C12 结构相似,熔、沸点:S2Br2<S2C12
C. S2C12是含有极性键和非极性键的极性分子
D. S2C12 与 H2O 反应的化学方程式为2S2C12 +2H2O=SO2↑+3S↓+4HC1,若反应中转移6mol电子,则生成3mol硫单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,不属于取代反应的是
A. ![]() +HNO3
+HNO3![]()
![]() +H2O
+H2O
B. CH2=CH2+Br2 ![]() BrCH2CH2Br
BrCH2CH2Br
C. CH4+Cl2![]() CH3Cl+HCl
CH3Cl+HCl
D. CH3CH2CH2Br+NaOH![]() CH3CH2CH2OH+NaBr
CH3CH2CH2OH+NaBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,我国多地频现种种极端天气,二氧化碳、氮氧化物、二氧化硫是导致极端天气的重要因素.
![]() 活性炭可用于处理大气污染物NO,在1L恒容密闭容器中加入
活性炭可用于处理大气污染物NO,在1L恒容密闭容器中加入![]() NO和
NO和![]() 固体活性炭
固体活性炭![]() 无杂质
无杂质![]() ,生成气体E和气体
,生成气体E和气体![]() 当温度分别在
当温度分别在![]() 和
和![]() 时,测得平衡时各物质的物质的量如下表:
时,测得平衡时各物质的物质的量如下表:
| 活性炭 | NO | E | F |
|
|
|
|
|
|
|
|
|
|
![]() 结合上表数据,写出NO与活性炭反应的化学方程式 ______ ;
结合上表数据,写出NO与活性炭反应的化学方程式 ______ ;
![]() 上述反应的平衡常数表达式
上述反应的平衡常数表达式![]() ______ ,根据上述信息判断,
______ ,根据上述信息判断,![]() 和
和![]() 的关系是 ______ ;
的关系是 ______ ;
A.![]() B.
B.![]() C.无法比较
C.无法比较
![]() 在
在![]() 下反应达到平衡后,下列措施能改变NO的转化率的是 ______ ;
下反应达到平衡后,下列措施能改变NO的转化率的是 ______ ;
![]() 增大
增大![]()
![]() 增大压强
增大压强![]() 升高温度
升高温度![]() 移去部分F
移去部分F
![]() 碘循环工艺不仅能吸收
碘循环工艺不仅能吸收![]() 降低环境污染,同时又能制得
降低环境污染,同时又能制得![]() ,具体流程如图所示
,具体流程如图所示

![]() 用离子方程式表示反应器中发生的反应 ______ ;
用离子方程式表示反应器中发生的反应 ______ ;
![]() 用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出
用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出![]() 的目的是 ______ ;
的目的是 ______ ;
![]() 开发新能源是解决大气污染的有效途径之一.直接甲醇燃料电池
开发新能源是解决大气污染的有效途径之一.直接甲醇燃料电池![]() 简称
简称![]() 由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图所示
由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图所示

通过a气体的电极是原电池的 ______ 极![]() 填“正”或“负”
填“正”或“负”![]() ,b电极反应式为 ______ .
,b电极反应式为 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中p表示压强,T表示温度,n表示物质的量):

根据以上规律判断,下列结论正确的是( )
A.反应Ⅰ:ΔH>0,p2>p1B.反应Ⅱ:ΔH>0,T1>T2
C.反应Ⅲ:ΔH>0,T2>T1或ΔH<0,T2<T1D.反应Ⅳ:ΔH<0,T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某工业废水中含有大量![]() ,较多的
,较多的![]() 及部分污泥,通过下列流程可从该废水中回收
及部分污泥,通过下列流程可从该废水中回收![]() 晶体及金属Cu。
晶体及金属Cu。

![]() 固体混合物是______
固体混合物是______![]() 填化学式
填化学式![]() ,试剂乙为______
,试剂乙为______![]() 填物质名称
填物质名称![]()
![]() 步骤3中发生反应的离子方程式为______
步骤3中发生反应的离子方程式为______
![]() 步骤4中涉及的操作是:蒸发浓缩、______、过滤、洗涤、干燥;蒸发浓缩、过滤操作中均用到的玻璃仪器是______
步骤4中涉及的操作是:蒸发浓缩、______、过滤、洗涤、干燥;蒸发浓缩、过滤操作中均用到的玻璃仪器是______
![]() 粗铜中常混有少量氧化亚铜
粗铜中常混有少量氧化亚铜![]() ,氧化亚铜与稀硫酸反应,会产生单质铜,同时溶液变蓝。试写出该反应的离子方程式______。
,氧化亚铜与稀硫酸反应,会产生单质铜,同时溶液变蓝。试写出该反应的离子方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】厌氧氨化法(Anammox)是一种新型的氨氮去除技术,下列说法中不正确的是

A. 1mol NH4+ 所含的质子总数为10NA
B. 联氨(N2H4)中含有极性键和非极性键
C. 过程II属于氧化反应,过程IV属于还原反应
D. 过程I中,参与反应的NH4+与NH2OH的物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下,某恒容容器中发生反应SO2(g)+NO2(g)![]() SO3(g)+NO(g),其平衡常数K=0.24,下列说法正确的是
SO3(g)+NO(g),其平衡常数K=0.24,下列说法正确的是
A.该温度下反应2SO2(g)+2NO2(g)![]() 2SO3(g)+2NO(g)的平衡常数为0.48
2SO3(g)+2NO(g)的平衡常数为0.48
B.若该反应ΔH<0,则升高温度化学平衡常数K减小
C.若升高温度,逆反应速率减小
D.改变条件使平衡正向移动,则平衡时容器中![]() 一定比原平衡小
一定比原平衡小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是
A. 标准状况下,11.2L14CO2含有的中子数为11NA
B. 5.6gFe粉与足量S粉加热充分反应转移的电子数为0.2NA,
C. 1molNa2O2固体中所含离子数目为4NA
D. 1LpH=6的纯水中含有OHˉ的数目为10-8NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com