
【题目】S2C12是广泛用于橡胶工业的硫化剂,常温下,S2C12是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。S2Cl2的结构与H2O2类似,如下图所示,下列说法正确的是

A. S2C12分子中的两个S原子均是sp杂化
B. S2Br2 与 S2C12 结构相似,熔、沸点:S2Br2<S2C12
C. S2C12是含有极性键和非极性键的极性分子
D. S2C12 与 H2O 反应的化学方程式为2S2C12 +2H2O=SO2↑+3S↓+4HC1,若反应中转移6mol电子,则生成3mol硫单质
【答案】C
【解析】
A. S2C12分子中的每个S原子价层电子对数=2+2=4,所以采取sp3杂化,故A错误;
B. S2Br2 与 S2C12均属于分子晶体,结构相似的分子晶体,相对分子质量越大,则熔、沸点越高,故熔、沸点:S2Br2>S2C12,故B错误;
C. S2Cl2的结构与H2O2类似,为Cl-S-S-Cl,其中的S-S为非极性键,S-Cl键为极性键,但正负电荷中心不重合,所以是极性分子,故C正确;
D. 2S2C12 +2H2O=SO2↑+3S↓+4HC1根据此方程式可知,有1个S原子从+1价升到+4价,有3个S原子从+1价降到0价,生成3个S,转移的电子数为3e-,故反应中转移6mol电子,则生成6mol硫单质,故D错误;
故选C。


科目:高中化学 来源: 题型:
【题目】下列用于解释事实的方程式书写不正确的是
A.0.1mol/L氨水的pH约为11.1:NH3·H2O![]() NH4++OH-
NH4++OH-
B.用明矾 [KAl(SO4)2·12H2O]作净水剂:Al3++3H2O![]() Al(OH)3(胶体)+3H+
Al(OH)3(胶体)+3H+
C.用饱和Na2CO3溶液处理水垢中的CaSO4(微溶):Ca2++CO32-=CaCO3↓
D.向K2Cr2O7溶液中滴加少量浓H2SO4,溶液橙色加深:![]() (橙色)+H2O
(橙色)+H2O![]() 2CrO42-(黄色)+2H+
2CrO42-(黄色)+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是在实验室进行氨气快速制备与性质实验的组合装置,部分固定装置未画出。
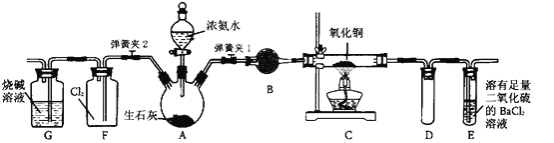
(1)在组装好装置后,若要检验A~E装置的气密性,其操作是首先____,然后微热A,观察到E中有气泡冒出,移开酒精灯或松开双手,E中导管有水柱形成,说明装置气密性良好。
(2)装置B中盛放的试剂是________。
(3)点燃C处酒精灯,关闭弹簧夹2,打开弹簧夹l,从分液漏斗放出浓氨水至浸没烧瓶中固体后关闭分液漏斗,稍候片刻,装置C中黑色固体逐渐变红,装置E中溶液里出现大量气泡,同时还可能产生的现象是________;从E中逸出液面的气体可以直接排入空气,请写出在C中发生反应的化学方程式:________。
(4)当C中固体全部变红色后,关闭弹簧夹1,慢慢移开酒精灯,待冷却后,称量C中固体质量,若反应前固体质量为16 g,反应后称重固体质量减少2.4 g,通过计算确定该固体产物的成分是________(用化学式表示)。
(5)在关闭弹簧夹1后,打开弹簧夹2,残余气体进入F中,很快发现装置F中产生白烟,同时发现G中溶液迅速倒吸流入F中。请写出产生白烟的化学方程式:________,迅速产生倒吸的原因是________。
(6)为了汪明一水合氨是弱碱,甲、乙两同学分别设计以下实验进行探究。
①甲同学用pH试纸测得室温下0.l mol/L氨水pH为10,则认定一水合氨是弱电解质,理由是________。
②乙同学取出10 mL 0.1 mol/L氨水,滴入2滴酚酞试液,显粉红色,再加入NH4Cl晶体少量,观察到的现象是________,则证明一水台氨是弱电解质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用下图装置制备家用消毒液,并探究其性质。
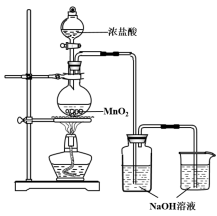
反应停止后,取洗气瓶中无色溶液5mL分别进行了如下实验:
操作 | 现象 |
a. 测溶液pH, 并向其中滴加2滴酚酞 | pH = 13, 溶液变红,5min后褪色 |
b. 向其中逐滴加入盐酸 | 溶液逐渐变成黄绿色 |
(1)写出利用上述装置制备消毒液涉及反应的化学方程式 、 。
(2)查阅资料:酚酞的变色范围为8.2~10,且酚酞在强碱性溶液中红色会褪去
为探究操作a中溶液褪色的原因,又补充了如下实验:
操作 | 现象 |
取 NaOH溶液,向其中滴加2滴酚酞 | 溶液变红,30min后褪色 |
获得结论:此实验小组制备的消毒液具有 性。
(3) 该小组由操作b获得结论:随着溶液酸性的增强,此消毒液的稳定性下降。
① 操作b中溶液变成黄绿色的原因: (用离子方程式表示)。
② 有同学认为由操作b获得上述结论并不严谨,需要进一步确认此结论的实验方案是 。
(4) 有效氯的含量是检测含氯消毒剂消毒效果的重要指标。具体用“单位质量的含氯消毒液在酸性条件下所能释放出氯气的质量”进行表征,一般家用消毒液有效氯含量在5%以上。小组同学进行如下实验测定有效氯:取此消毒液5 g,加入20 mL 0.5 mol·L-1 KI溶液,10 mL 2 mol·L-1的硫酸溶液;加几滴淀粉溶液后,用0.1 mol·L-1 Na2S2O3溶液滴定生成的I2,达滴定终点时消耗Na2S2O3 20 mL。(已知:2S2O32- + I2 === S4O62- + 2I-) 。注:相对原子质量Cl35.5,Na23,S32,O 16 ,I 127, K39
①达到滴定终点时的实验现象是 。
②此消毒液有效氯含量为 %(保留一位有效数字)。获得结论:此实验制得的消毒液 (填“符合”或“不符合”)家用要求。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将镁片、铝片平行插入一定浓度的NaOH溶液中,用导线连成闭合回路,该装置在工作时,下列叙述中正确的是
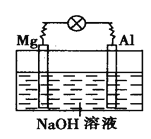
A. 镁比铝活泼,镁失去电子被氧化成Mg2+
B. 铝是电池的负极,开始工作时溶液中会立即有白色沉淀生成
C. 该装置的内、外电路中,均是电子的定向移动形成
D. 该装置开始工作时,铝片表面的氧化膜可不必处理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时按如下化学方程式分解:2Mg5Al3(OH)19(H2O)4![]() 27H2O↑+10MgO+3Al2O3
27H2O↑+10MgO+3Al2O3
(1)写出该化合物作阻燃剂的两条依据____________。
(2)用离子方程式表示除去固体产物中Al2O3 的原理________。
Ⅱ.磁性材料A是由两种元素组成的化合物,某研究小组按如图流程探究其组成:
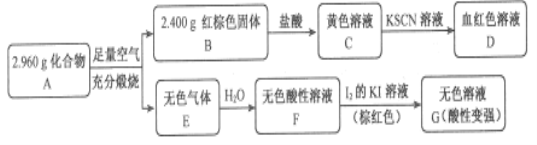
请回答:
(1)A的组成元素为_________(用元素符号表示),化学式为______。
(2)已知化合物A能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518 g·L-1),写出该反应的离子方程式_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】容积均为1L的甲、乙两个恒容容器中,分别充入2molA、2molB和1molA、1molB,相同条件下,发生下列反应:A(g)+B(g)![]() xC(g) △H<0。测得两容器中c(A)随时间t的变化如上图所示,下列说法不正确的是
xC(g) △H<0。测得两容器中c(A)随时间t的变化如上图所示,下列说法不正确的是

A.x=1
B.此条件下,该反应的平衡常数K=4
C.给乙容器升温可缩短反应达平衡的时间但不能提高平衡转化率
D.甲和乙的平衡转化率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,只改变反应物中n(SO2)对反应2SO2(g)+O2(g)2SO3(g)的影响如图所示,下列说法正确的是( )
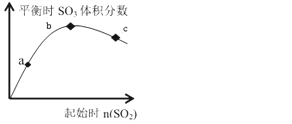
A. 反应a、b、c点均为平衡点,且b点时SO2的转化率最高
B. b点时SO2与O2 的物质的之比约为2:1
C. a、b、c 三点平衡常数: Kb>Kc>Ka
D. a、b、c 三点反应速率大小为: vb>vc>va
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)可用于制备FeSO4,其流程如下:
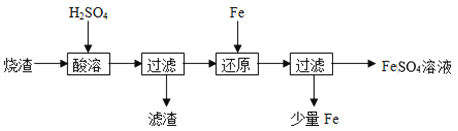
(1)“酸溶”时,提高反应速率的措施有__________(写一条)。
(2)加入Fe粉还原后,检验Fe3+是否反应完全的试剂为_____。
(3)写出“还原”步骤中,Fe粉和Fe3+反应的离子方程式:_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com