
����Ŀ��FePO4��һ��������ˮ�İ�ɫ���壬���ý�����������Ҳ�������Ʊ��綯������ص���������LiFePO4��ʵ��������FeSO47H2O��H3PO4���������Ʊ�FePO4 ��LiFePO4��������ͼ��
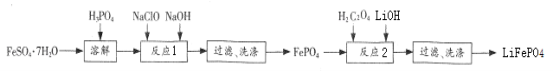
�ش��������⣺
(1)���ܽ���ʱH3PO4���˹���̫���ԭ����__________��
(2)��ϴ��FePO4�����IJ�����__________��
���������ϴ�Ӻ�������FePO4���Գ���ɫ������FePO4������ܻ��е�������_____��
(3)����Ӧ1��ʱ�ܷ�Ӧ�����ӷ���ʽ��_____________��
(4)����Ӧ2��ʱ�ܷ�Ӧ�Ļ�ѧ����ʽ����2LiOH + 6H2C2O4 + 2FePO4![]() 2LiFePO4 + 7CO2 + 5X +7H2O ������X�Ļ�ѧʽΪ____��ÿ����1molLiFePO4���÷�Ӧת��_______mole-��
2LiFePO4 + 7CO2 + 5X +7H2O ������X�Ļ�ѧʽΪ____��ÿ����1molLiFePO4���÷�Ӧת��_______mole-��
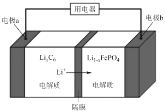
(5)LiFePO4����ȶ��Ըߡ���ȫ���Ի����Ѻã��õ�ص��ܷ�Ӧʽ�ǣ�LiFePO4 + C6 ![]() Li1��xFePO4 + LixC6����ŵ�ʱ����ԭ����ͼ��ʾ��
Li1��xFePO4 + LixC6����ŵ�ʱ����ԭ����ͼ��ʾ��
���ʱ��a���ĵ缫��ӦʽΪ_____________��
�ŵ�ʱ��b���ĵ缫��ӦʽΪ_______________��
���𰸡���ֹ������Ӧ������NaOH���˷�ԭ�� ��©���м�������ˮ�պý�û��������ˮ�������ظ�����2��3�� Fe(OH)3 2 Fe2+ + ClO��+ 2H3PO4 + 4 OH��![]() 2FePO4��+ Cl��+ 5 H2O CO 3.5 C6 + xLi+ + xe��
2FePO4��+ Cl��+ 5 H2O CO 3.5 C6 + xLi+ + xe��![]() LixC6 Li1��xFePO4 + xLi+ + xe��
LixC6 Li1��xFePO4 + xLi+ + xe��![]() LiFePO4
LiFePO4
��������
(1)��ֹ������Ӧ������NaOH���˷�ԭ�ϣ������ܽ���ʱH3PO4���˹���̫�ࣻ
(2)��ϴ��FePO4�����IJ�������©���м�������ˮ�պý�û��������ˮ�������ظ�����2��3�Σ�
���������ϴ�Ӻ�������FePO4���Գ���ɫ������FePO4������ܻ��е�������Fe(OH)3��
(3)����Ӧ1��ʱ�������ӱ�����������������������������������������ӷ�Ӧ�����������������ܷ�Ӧ�����ӷ���ʽ��2 Fe2+ + ClO��+ 2H3PO4 + 4 OH��=2FePO4��+ Cl��+ 5 H2O��
(4)���������غ��֪����Ӧ2LiOH + 6H2C2O4 + 2FePO4![]() 2LiFePO4 + 7CO2 + 5X +7H2O�ұ�����5��C��5��O��X�ļ�����Ϊ5����X�Ļ�ѧʽΪCO����Ӧ��̼Ԫ����+3�۽�Ϊ+2�ۡ���Ԫ����+3�۽�Ϊ+2�ۣ�̼Ԫ����+3����Ϊ+4�ۣ�����������ԭ��Ӧԭ����ÿ����2molLiFePO4��������7mol CO2��ת��7mole-����ÿ����1molLiFePO4���÷�Ӧת��3.5mole-��
2LiFePO4 + 7CO2 + 5X +7H2O�ұ�����5��C��5��O��X�ļ�����Ϊ5����X�Ļ�ѧʽΪCO����Ӧ��̼Ԫ����+3�۽�Ϊ+2�ۡ���Ԫ����+3�۽�Ϊ+2�ۣ�̼Ԫ����+3����Ϊ+4�ۣ�����������ԭ��Ӧԭ����ÿ����2molLiFePO4��������7mol CO2��ת��7mole-����ÿ����1molLiFePO4���÷�Ӧת��3.5mole-��
(5)ԭ������������������ƶ����������缫b�ƶ�����缫bΪ���������ʱb�缫Ϊ����������a����C6�õ��Ӳ���LixC6���缫��ӦʽΪC6 + xLi+ + xe��![]() LixC6��
LixC6��
�ŵ�ʱ������b����Li1��xFePO4�õ��Ӳ���LiFePO4���缫��ӦʽΪLi1��xFePO4 + xLi+ + xe��=LiFePO4��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪H2(g)��C2H4(g)��C2H5OH(1)��ȼ���ȷֱ���-285.8kJ��mol-1��-1411.0kJ��mol-1��-1366.8kJ��mol-1,����C2H4(g)��H2O(l)��Ӧ����C2H5OH(l)����HΪ( )
A. -44.2kJ��mol-1 B. +44.2kJ��mlo-1
C. -330kJ��mol-1 D. +330kJ��mlo-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ��P4(s)��3NaOH(aq)��3H2O(l)��3NaH2PO2(aq)��PH3(g) ��H��0���Ƶõ�NaH2PO2�����ڻ�ѧ����������˵����ȷ����

A. P4������Pԭ�Ӿ�����8�����ȶ��ṹ
B. ��Ӧ��NaOH����ԭ��
C. �÷�Ӧ���Է����У���S<0
D. ��Ӧ������1 mol NaH2PO2��ת�Ƶ�����ĿΪ3��6.02��1023
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ˮ����Խ��Խ�����������ӣ�����ͨ��Ĥ��س�ȥ��ˮ�е������ƺͶ��ȱ�����![]() ����ͬʱ���ô�װ�õĵ��������϶�ͭ������˵���������
����ͬʱ���ô�װ�õĵ��������϶�ͭ������˵���������

A. ���缫Ӧ��Y������
B. ��Ӧ�����м����ұ�������ҺpH������
C. A���ĵ缫��ӦʽΪ![]() +2e-+H+=Cl-+
+2e-+H+=Cl-+![]()
D. �����·����0.2 mole-ת��ʱ��A�������ӵ�H+�ĸ���Ϊ0.1NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����ұ���Ѿ���õ������������ijɷּ�����������������Ϊ��TiO251.00%��Al2O319.34%��MgO7.20%��CaO4.00%��SiO218.46%��ͨ�����й������̿��Եõ����������Ѻ�ij�ͷ���ɸ����ѧʽΪNa4Al4Si4O16 9H2O����
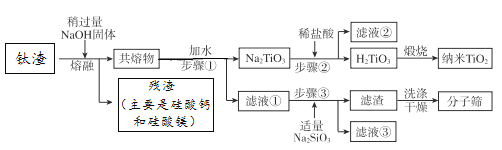
����˵������ȷ����
A. �����е�TiO2��SiO2�����ڼ���������
B. ��Һ��������ֻ��NaAlO2��NaOH
C. ������м�������ʱ����Ӧ�����ӷ���ʽ��Na2TiO3 + 2H+![]() H2TiO3��+2Na+
H2TiO3��+2Na+
D. ������м�������Na2SiO3ʱ����Ӧ�Ļ�ѧ����ʽΪ��4NaAlO2 + 4Na2SiO3 +13H2O ![]() Na4Al4Si4O16 9H2O�� + 8NaOH
Na4Al4Si4O16 9H2O�� + 8NaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2S2O3��һ������,ʵ��������0.01 mol��L-1��Na2S2O3��Һ�ζ�I2��Һ,�����ķ�ӦΪ��I2+2Na2S2O32NaI+Na2S4O6,����˵����������(��)
A. �õζ���ѡ����ͼ��ʾװ��ʾ����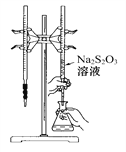
B. �õζ����ü�����ָ��
C. Na2S2O3�Ǹ÷�Ӧ�Ļ�ԭ����
D. �÷�Ӧ��ÿ����2 mol Na2S2O3,����ת����Ϊ4 mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У����ڵ�������ܵ������
A.FeB.NaCl��ҺC.Һ̬HClD.���ڵ�NaCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������̬����ɵĻ������0.1 mol����ȫȼ�յ�0.15 mol CO2��3.6 g H2O�����й��ڸû�������˵����ȷ����
A. һ������ϩB. һ��û����ϩ
C. �����м���D. һ��û������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Q��R��X��Y��Z��L����Ԫ�ص�ԭ��������������R��L��ͬ����Ԫ�أ�R�������������ȴ�����������1��L�ĵ��ʳ��³�ѹ�����Ϻ�ɫ���塣Q��X�γɵ����ӻ�����XQ�Ǽ�ʯ�ҵ���Ҫ�ɷ֡�X��Y��Zλ��ͬһ���ڣ�Y����Χ��������������������6����Zλ��ds���Ҳ��ܺ�ϡ���ᷴӦ����H2����ش��������⣺
��1��Q�ļ۲�����Ų�ʽΪ___________________��L�ĺ�����HLO3��L���ӻ���ʽΪ__________�����LO3-�����ӹ���Ϊ________________��
��2��ZR42-��������______����ZSO4��Һ�м������KCN�����������[Z��CN��4]2������1mol��������к��еĦм�����Ŀ��_______����Zͬ���ڵ�Ԫ���У���Zԭ��������������ȵ�Ԫ�ػ���_________����Ԫ�ط��ţ�
��3��Y�������������ͼ��ʾ��������״�ṹ�����������Ļ�ѧʽΪ______________��

��4��X��Z�ľ���ѻ�ģ����ͬ����λ��Ϊ______________����֪Xԭ�Ӱ뾶ԼΪ200pm������X���ܶ�Ϊ__________________g/cm3(������������λ��Ч����)��
��5��XL2���庬�в�״�ṹ���������ǿ���Թ��ۼ�������Է��»��������ӣ���XL2�ľ���������___________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com