
【题目】H2S2O3是一种弱酸,实验室欲用0.01 mol·L-1的Na2S2O3溶液滴定I2溶液,发生的反应为:I2+2Na2S2O32NaI+Na2S4O6,下列说法合理的是( )
A. 该滴定可选用如图所示装置示剂;
B. 该滴定可用甲基橙作指;
C. Na2S2O3是该反应的还原剂;
D. 该反应中每消耗2 mol Na2S2O3,电子转移数为4 mol;
【答案】C
【解析】分析:A、Na2S2O3溶液显碱性;
B、根据碘遇淀粉溶液变蓝色分析解答;
C、根据Na2S2O3中S元素化合价变化分析;
D、根据Na2S2O3中S元素化合价变化解答。
详解:A、Na2S2O3溶液显碱性,应该用碱式滴定管,A错误;
B、溶液中有单质碘,加入淀粉溶液呈蓝色,碘与Na2S2O3发生氧化还原反应,当反应终点时,单质碘消失,蓝色褪去,B错误;
C、Na2S2O3中S元素化合价由+2价升高到+2.5价,失去电子被氧化,作还原剂,C正确;
D、Na2S2O3中S元素化合价由+2价升高到+2.5价,因此反应中每消耗2mol Na2S2O3,转移2mol电子,D错误;答案选C。


科目:高中化学 来源: 题型:
【题目】氯碱工业是最基本的化学工业之一,其产品用途广泛。
(1)写出氯碱工业电解食盐水的离子方程式____________。
(2)①图1是氯碱工业中阳离子交换膜电解槽示意图(“阳离子交换膜”特性是只允许阳离子通过而阻止阴离子和气体通过)。
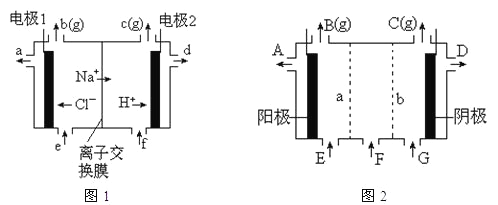
图1中电极1应连接电源的__极(填“正”或“负”极);理论上讲,从f口加入纯水即可,但实际生产中,纯水中要加入一定量的NaOH溶液,其原因是_____。
②图2是根据氯碱工业中离子交换膜技术原理,设计的电解Na2SO4溶液生产NaOH和H2SO4溶液的装置。其中a、b处均设有离子交换膜,则a处为__(填“阳”、“阴”)离子交换膜。阳极的电极反应式是___。从D口流出的物质为____。
(3)某同学采用如下装置对氯碱工业中电解食盐水的条件进行探究,记录如下:
装置 | 编号 | 条件控制 | 测定结果 | ||||
电极材料 | 溶液浓度 | 温度/℃ | *电解电压/V | 气体V阴:V阳 | |||
阴极 | 阳极 | ||||||
| I | C | C | 1 mol/L | 25 | 8 | >1:1 |
II | 饱和 | 25 | 5 | ≈1:1 | |||
III | 饱和 | 50 | 4 | ≈1:1 | |||
IV | Fe | C | 饱和 | 50 | 3.5 | ≈1:1 | |
电解电压:开始发生电解反应时的电压
①对比实验I和Ⅱ阴、阳极气体体积比,推测实验I阳极可能有其它气体生成,其它气体的化学式为_____。
②资料显示:“较低的电解电压有利于节能降耗……”。结合上表中Ⅲ和Ⅳ的数据,解释Ⅳ更有利于节能降耗的原因_______________。
(4)资料显示“氯碱工业中采用金属阳极材料,可以降低电解电压,实现节能降耗”,该同学用50℃的饱和NaCl溶液进行实验验证,结果如下:
装置 | 编号 | 电极材料 | 电解 电压/V | 现象 | |
阴极 | 阳极 | ||||
| V | Fe | Fe | 1.5 | 阴极:产生无色气体 U形管底部:有白色沉淀生成 |
VI | Fe | Cu | 2 | 阴极:产生无色气体 阳极:有白色胶状沉淀生成且逐渐增多 U形管底部:靠近阴极区白色胶状沉淀逐渐转化为淡黄色,最后变成砖红色 | |
实验V中,通过检验阴、阳极附近溶液所含离子,推断产生白色沉淀为Fe(OH)2 。该同学经查阅资料分析认为:“实验VI中白色沉淀是CuCl,淡黄色沉淀是CuOH。
i.阳极生成CuCl的电极反应式为_________。
ii.用化学用语和必要文字解释阴极区白色胶状沉淀转化为淡黄色的原因___________。
该同学通过以上探究认为,氯碱工业中不能采用Fe、Cu作阳极材料。
(5)综合以上探究,你对氯碱工业中电解食盐水条件控制的建议有 _____(至少写出两条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列烃①C4H8 ②C4H10 ③C6H12 ④C7H8分别完全燃烧,耗氧量分析正确的是
A. 等质量时耗氧量最多的是④
B. 等物质的量时耗氧量最少的是②
C. 等物质的量时③和④耗氧量相等
D. 某气态烃CxHy与足量O2恰好完全反应,如果反应前后气体体积不变(温度>100℃),则y=4;若体积减小,则y>4;反之,则y<4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FePO4是一种难溶于水的白色固体,可用金属防腐剂,也可用于制备电动汽车电池的正极材料LiFePO4。实验室利用FeSO47H2O和H3PO4(弱酸)制备FePO4 、LiFePO4流程如下图:
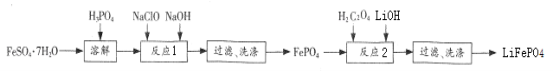
回答下列问题:
(1)“溶解”时H3PO4不宜过量太多的原因是__________。
(2)①洗涤FePO4沉淀的操作是__________;
②若经多次洗涤后所得“FePO4”仍呈棕色,则“FePO4”最可能混有的杂质是_____。
(3)“反应1”时总反应的离子方程式是_____________。
(4)“反应2”时总反应的化学方程式是:2LiOH + 6H2C2O4 + 2FePO4![]() 2LiFePO4 + 7CO2 + 5X +7H2O ,其中X的化学式为____;每生成1molLiFePO4,该反应转移_______mole-。
2LiFePO4 + 7CO2 + 5X +7H2O ,其中X的化学式为____;每生成1molLiFePO4,该反应转移_______mole-。
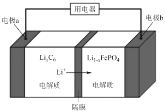
(5)LiFePO4电池稳定性高、安全、对环境友好,该电池的总反应式是:LiFePO4 + C6 ![]() Li1﹣xFePO4 + LixC6,其放电时工作原理如图所示。
Li1﹣xFePO4 + LixC6,其放电时工作原理如图所示。
则:充电时,a极的电极反应式为_____________;
放电时,b极的电极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,某密闭容器中发生反应:N2(g)+3H2(g)![]() 2NH3(g)。反应物N2的浓度在10s内从2mol/L变成1.5mol/L,则这10s内H2的反应速率为( )
2NH3(g)。反应物N2的浓度在10s内从2mol/L变成1.5mol/L,则这10s内H2的反应速率为( )
A. 0.05mol/LB. 0.05mol/(L·s)C. 0.15mol/(L·s)D. 0.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为2L密闭容器中加人反应物A、B,发生如下反应:A+2B=3C.经2min后,A的浓度从开始时的1.0mol/L降到0.8mol/L.已知反应开始时B的浓度是1.2mol/L.则:2min末B的浓度___________、C的物质的量_________,2min内,用A物质的浓度变化来表示该反应的反应速率,即V(A)=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐是一种高效绿色氧化剂,可用于废水和生活用水的处理。从环境保护的角度看,制备高铁酸盐较好的方法为电解法:Fe+2H2O+2OH![]() FeO42-+3H2↑,工作原理如图所示。己知:Na2FeO4只在强碱性条件下稳定,易被H2还原。下列说法正确的是
FeO42-+3H2↑,工作原理如图所示。己知:Na2FeO4只在强碱性条件下稳定,易被H2还原。下列说法正确的是
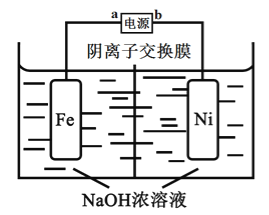
A. b是电源的正极
B. 阳极电极反应为Fe-6e-+4H2O= FeO42-+ 8H+
C. 电解过程中,需要将阴极产生的气体及时排出
D. 当电路中通过1mol电子的电量时,会有11.2L的H2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气发生反应的装置。
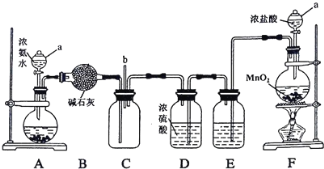
请回答下列问题:
(1)仪器a的名称为_________;装置A的圆底烧瓶中盛放的固体物质可选用__________(填序号)。
a.氯化钠 b.氢氧化钠 c.碳酸钙
(2)装置F的圆底烧瓶中发生反应的离子方程式为___________;装置E的洗气瓶中盛放的试剂为 ____________。
(3)反应过程中,装置C的集气瓶中有大量白烟产生,另一种产物为空气的主要成分之一,该反应的化学方程式为 _________。
(4)从装置C的b处逸出的尾气中含有少量Cl2,为防止其污染环境,可将尾气通过盛有 ________溶液的洗气瓶。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com