
【题目】氯碱工业是最基本的化学工业之一,其产品用途广泛。
(1)写出氯碱工业电解食盐水的离子方程式____________。
(2)①图1是氯碱工业中阳离子交换膜电解槽示意图(“阳离子交换膜”特性是只允许阳离子通过而阻止阴离子和气体通过)。
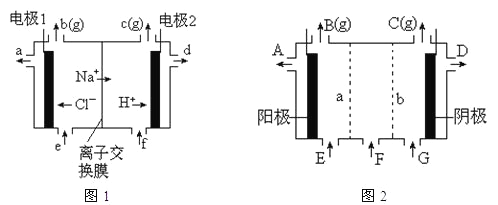
图1中电极1应连接电源的__极(填“正”或“负”极);理论上讲,从f口加入纯水即可,但实际生产中,纯水中要加入一定量的NaOH溶液,其原因是_____。
②图2是根据氯碱工业中离子交换膜技术原理,设计的电解Na2SO4溶液生产NaOH和H2SO4溶液的装置。其中a、b处均设有离子交换膜,则a处为__(填“阳”、“阴”)离子交换膜。阳极的电极反应式是___。从D口流出的物质为____。
(3)某同学采用如下装置对氯碱工业中电解食盐水的条件进行探究,记录如下:
装置 | 编号 | 条件控制 | 测定结果 | ||||
电极材料 | 溶液浓度 | 温度/℃ | *电解电压/V | 气体V阴:V阳 | |||
阴极 | 阳极 | ||||||
| I | C | C | 1 mol/L | 25 | 8 | >1:1 |
II | 饱和 | 25 | 5 | ≈1:1 | |||
III | 饱和 | 50 | 4 | ≈1:1 | |||
IV | Fe | C | 饱和 | 50 | 3.5 | ≈1:1 | |
电解电压:开始发生电解反应时的电压
①对比实验I和Ⅱ阴、阳极气体体积比,推测实验I阳极可能有其它气体生成,其它气体的化学式为_____。
②资料显示:“较低的电解电压有利于节能降耗……”。结合上表中Ⅲ和Ⅳ的数据,解释Ⅳ更有利于节能降耗的原因_______________。
(4)资料显示“氯碱工业中采用金属阳极材料,可以降低电解电压,实现节能降耗”,该同学用50℃的饱和NaCl溶液进行实验验证,结果如下:
装置 | 编号 | 电极材料 | 电解 电压/V | 现象 | |
阴极 | 阳极 | ||||
| V | Fe | Fe | 1.5 | 阴极:产生无色气体 U形管底部:有白色沉淀生成 |
VI | Fe | Cu | 2 | 阴极:产生无色气体 阳极:有白色胶状沉淀生成且逐渐增多 U形管底部:靠近阴极区白色胶状沉淀逐渐转化为淡黄色,最后变成砖红色 | |
实验V中,通过检验阴、阳极附近溶液所含离子,推断产生白色沉淀为Fe(OH)2 。该同学经查阅资料分析认为:“实验VI中白色沉淀是CuCl,淡黄色沉淀是CuOH。
i.阳极生成CuCl的电极反应式为_________。
ii.用化学用语和必要文字解释阴极区白色胶状沉淀转化为淡黄色的原因___________。
该同学通过以上探究认为,氯碱工业中不能采用Fe、Cu作阳极材料。
(5)综合以上探究,你对氯碱工业中电解食盐水条件控制的建议有 _____(至少写出两条)。
【答案】2Cl- + 2H2O ![]() Cl2↑+ H2↑ + 2OH- 正 增强溶液的导电性,又不影响NaOH纯度 阴 4OH--4e-== 2H2O + O2↑ NaOH溶液 O2 IV中采用了Fe(金属材料)作电极(阴极),Cu–e- + Cl- = CuCl 阴极区产生的OH-使CuCl沉淀转化为更难溶液的CuOH沉淀 CuCl + OH- = CuOH + Cl- 采用饱和食盐水;溶液保持较高温度;应用不参与反应的金属电极(答出两点即可)
Cl2↑+ H2↑ + 2OH- 正 增强溶液的导电性,又不影响NaOH纯度 阴 4OH--4e-== 2H2O + O2↑ NaOH溶液 O2 IV中采用了Fe(金属材料)作电极(阴极),Cu–e- + Cl- = CuCl 阴极区产生的OH-使CuCl沉淀转化为更难溶液的CuOH沉淀 CuCl + OH- = CuOH + Cl- 采用饱和食盐水;溶液保持较高温度;应用不参与反应的金属电极(答出两点即可)
【解析】
(1)根据电解原理写出电解食盐水的离子方程式;
(2) ①电解池中,阴离子氯离子移向阳极,与阳极相连的是电源的正极,加入一定量的NaOH溶液可以增强溶液的导电性,据此解答;
②惰性电极电解硫酸钠溶液,相当于电解水,阳极发生4OH--4e-=2H2O+O2↑,阴极发生2H++2e-=H2↑,以此分析;
(3)①实验I和实验Ⅱ在其他条件相同时,所用食盐水的浓度不同,实验I浓度小,可能是阳极先是Cl-失电子生成氯气,待Cl-消耗完,氢氧根离子放电生成氧气;
②通过Ⅲ和Ⅳ组的数据对比,Ⅳ采用金属阴极材料,电解电压较低,有利于节能降耗;
(4)i. 实验VI中,铜作阳极,电解质溶液是氯化钠溶液,铜失电子生成一价铜离子,一价铜离子和溶液中的氯离子结合生成难溶的氯化亚铜沉淀,以此写出电极反应式;
ii. 实验VI中,阴极区氢离子放电,产生OH-,使CuCl转化为更难溶的CuOH;
(5)通过对比6组实验可知,在较高温度下,采用饱和食盐水,应用不参与反应的金属电极有利于电解节能降耗。
(1) 根据电解原理写出电解食盐水的离子方程式为2Cl- + 2H2O ![]() Cl2↑+ H2↑ + 2OH-,
Cl2↑+ H2↑ + 2OH-,
因此,本题正确答案是:2Cl- + 2H2O ![]() Cl2↑+ H2↑ + 2OH- ;
Cl2↑+ H2↑ + 2OH- ;
(2)①电解池中,阴离子氯离子移向阳极,与阳极相连的是电源的正极,所以电极1应连接电源的正极,加入一定量的NaOH溶液可以增强溶液的导电性,
因此,本题正确答案是:正;增强溶液的导电性,又不影响NaOH纯度;
②惰性电极电解硫酸钠溶液,相当于电解水,阳极发生4OH--4e-=2H2O+O2↑,B为氧气,电解时氢氧根离子不断向阳极移动,所以a为阴离子交换膜;阴极发生2H++2e-=H2↑,C为氢气,D口流出的物质为NaOH溶液,
因此,本题正确答案是:阴;4OH--4e-== 2H2O + O2↑;NaOH溶液;
(3)①实验I和实验Ⅱ在其他条件相同时,所用食盐水的浓度不同,实验I浓度小,可能是阳极先是Cl-失电子生成氯气,待Cl-消耗完,氢氧根离子放电生成氧气,使阴阳两极产生的气体体积比>1:1,
②通过Ⅲ和Ⅳ组的数据对比,Ⅳ采用金属阴极材料,电解电压较低,有利于节能降耗,
因此,本题正确答案是:O2 ;IV中采用了Fe(金属材料)作电极(阴极);
(4) i. 实验VI中,铜作阳极,电解质溶液是氯化钠溶液,铜失电子生成一价铜离子,一价铜离子和溶液中的氯离子结合生成难溶的氯化亚铜沉淀,电极反应式为Cu–e- + Cl- = CuCl;
因此,本题正确答案是:Cu–e- + Cl- = CuCl;
ii. 实验VI中,阴极区氢离子放电,产生OH-,使CuCl转化为更难溶的CuOH,CuCl + OH- = CuOH + Cl- ;
因此,本题正确答案是:阴极区产生的OH-使CuCl沉淀转化为更难溶液的CuOH沉淀 ,CuCl + OH- = CuOH + Cl- ;
(5)通过对比6组实验,在较高温度下,采用饱和食盐水,应用不参与反应的金属电极有利于电解节能降耗。
因此,本题正确答案是:采用饱和食盐水;溶液保持较高温度;应用不参与反应的金属电极(答出两点即可)。


科目:高中化学 来源: 题型:
【题目】按要求写出:
(1)溴化钾电子式_____________________。
(2)硫化钠电子式_____________________。
(3)二氧化碳的电子式______________。
(4)铵根离子的电子式_____________。
(5)氮气的电子式______________。
(6)甲烷的结构式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应“P4(s)+3NaOH(aq)+3H2O(l)=3NaH2PO2(aq)+PH3(g) ΔH>0”制得的NaH2PO2可用于化学镀镍。下列说法正确的是

A. P4分子中P原子均满足8电子稳定结构
B. 反应中NaOH作还原剂
C. 该反应能自发进行,则ΔS<0
D. 反应中生成1 mol NaH2PO2,转移电子数目为3×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)是二元弱酸(K1=5.9×10-2、K2=6.4×10-5)。向10mL稀H2C2O4溶液中滴加等浓度NaOH溶液,H2C2O4、HC2O4—、C2O42—的浓度分数δ随溶液pH变化的关系如图,以下说法正确的是( )
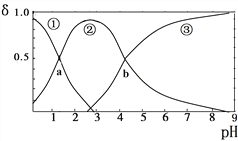
A. HC2O4—的浓度分数随pH增大而增大
B. 交点a处对应加入的NaOH溶液的体积为5mL
C. 交点b处c(H+)=6.4×10-5
D. pH=5时存在c(Na+)+c(H+)=c(C2O42—)+c(HC2O4—)+c(OH—)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚(![]() ),同时利用此装置的电能在铁上镀铜,下列说法错误的是
),同时利用此装置的电能在铁上镀铜,下列说法错误的是

A. 铁电极应与Y相连接
B. 反应过程中甲中右边区域溶液pH逐渐升高
C. A极的电极反应式为![]() +2e-+H+=Cl-+
+2e-+H+=Cl-+![]()
D. 当外电路中有0.2 mole-转移时,A极区增加的H+的个数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S2O3是一种弱酸,实验室欲用0.01 mol·L-1的Na2S2O3溶液滴定I2溶液,发生的反应为:I2+2Na2S2O32NaI+Na2S4O6,下列说法合理的是( )
A. 该滴定可选用如图所示装置示剂;
B. 该滴定可用甲基橙作指;
C. Na2S2O3是该反应的还原剂;
D. 该反应中每消耗2 mol Na2S2O3,电子转移数为4 mol;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是:
A. 反应达到平衡时,X的转化率为50% B. 反应可表示为X+3Y![]() 2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com