


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
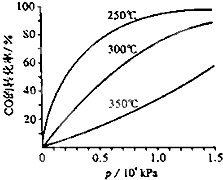 Ⅰ.研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
Ⅰ.研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
| ||
| △ |
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铜、酒精、冰醋酸分别属于非电解质、电解质、弱电解质 |
| B、煤的干馏、煤的液化都属于物理变化 |
| C、Fe(OH)3胶体和CuSO4溶液都是混合物 |
| D、冰醋酸、碱式碳酸铜、小苏打分别属于酸、碱、盐 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com