
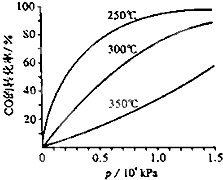
 Ⅰ.研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
Ⅰ.研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
| ||
| △ |
| 放电 |
| 充电 |
| ||
| △ |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 4 |
| 5 |
| c(SO3)?c(NO) |
| c(NO2)?c(SO2) |
| x2 |
| (a-x)(2a-x) |
| 8 |
| 3 |
| 放电 |
| 充电 |


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
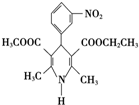 尼群地平片可用于治疗高血压.其药理作用是引起冠状动脉、肾小动脉等全身血管扩张,产生降压作用.它的主要成分的结构简式如下:
尼群地平片可用于治疗高血压.其药理作用是引起冠状动脉、肾小动脉等全身血管扩张,产生降压作用.它的主要成分的结构简式如下:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
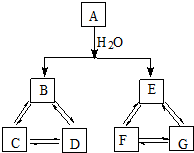 有A、B、C、D、E、F、G七种常见物质,它们满足下图所示转化关系.已知:
有A、B、C、D、E、F、G七种常见物质,它们满足下图所示转化关系.已知:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原电池是化学能转变为电能的装置 |
| B、构成原电池的正极和负极必须是两种不同的金属 |
| C、在原电池中,电子流出的一极是负极,该电极被还原 |
| D、原电池放电时,电流的方向是从负极到正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2Fe2++Cl2═2Fe3++2Cl- |
| B、2Br-+Cl2═Br2+2Cl- |
| C、4Fe2++2Br-+3Cl2═Br2+4Fe3++6Cl- |
| D、2Fe2++4Br-+3Cl2═2Br2+2Fe3++6Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、??①②③④ |
| B、???④ |
| C、???④⑤ |
| D、???④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com