
����Ŀ����������ҺW�ĵ����������ϵ�з�Ӧ��ͼ�е�ÿһ�����ʾ�йص�һ����Ҫ��Ӧ����������Ӧ�м�������ɵ�ˮ�Լ����ɵ�������������ȥ��������A��B��C��D��E�ڳ����¾�Ϊ��̬���ʣ�X��K����ѧ�����Ľ������ʣ�������Y��һ�ֱȽϺõ��ͻ���ϣ�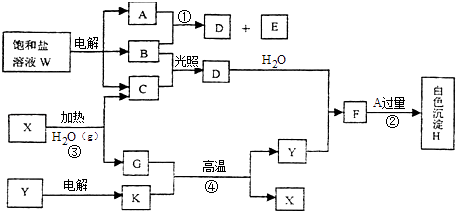
�ش��������⣺
��1��X��Y�Ļ�ѧʽ�ǣ�X �� Y ��
��2��A�ĵ���ʽ�� �� B�ľ��������� ��
��3����Ӧ�ڵ����ӷ���ʽ�� ��
��4����������ҺW���Ļ�ѧ����ʽ�� ��
��5����֪C��ȼ����Ϊ285.8kJ/mol����д��C���û�ѧʽ��ʾ��ȼ������Һ̬���ʵ��Ȼ�ѧ����ʽ ��
���𰸡�
��1��Fe��Al2O3
��2��![]() �����Ӿ���
�����Ӿ���
��3��Al3++3NH3?H2O=Al��OH��3��+3NH4+
��4��2NH4Cl ![]() Cl2��+H2��+2NH3��
Cl2��+H2��+2NH3��
��5��2H2��g��+O2��g��=2H2O��l������H=��571.6kJ/mol
���������⣺A��B��C��D��E�ڳ����¾�Ϊ��̬���ʣ�X��K����ѧ�����Ľ������ʣ�K�ڸ�����������X����÷�ӦΪ���ȷ�Ӧ��KΪ����XΪ����������Y��һ�ֱȽϺõ��ͻ���ϣ�Y�������������YΪ��������X��ˮ��������GΪ������������CΪ��������������ҺW�ĵ������������壬��B��C�ڹ�������������D����BΪCl2 �� ����DΪHCl��A��B��Ӧ����D��E����AΪNH3 �� EΪN2 �� ����WΪNH4Cl��D��Y��Ӧ����FΪAlCl3 �� F������İ�ˮ��Ӧ���ɰ�ɫ����HΪAl��OH��3 �� ��1����������ķ�����֪��XΪ����YΪ��������X��Y�Ļ�ѧʽ�ֱ�ΪFe��Al2O3 �� ���Դ��ǣ�Fe��Al2O3����2��AΪNH3 �� A�ĵ���ʽ�� ![]() ��BΪCl2 �� B�ľ��������Ƿ��Ӿ��壬���Դ��ǣ�
��BΪCl2 �� B�ľ��������Ƿ��Ӿ��壬���Դ��ǣ� ![]() �����Ӿ��壻��3����Ӧ�ڵ����ӷ���ʽ��Al3++3NH3H2O=Al��OH��3��+3NH4+ �� ���Դ��ǣ�Al3++3NH3H2O=Al��OH��3��+3NH4+����4��WΪNH4Cl����������ҺW���Ļ�ѧ����ʽ��2NH4Cl
�����Ӿ��壻��3����Ӧ�ڵ����ӷ���ʽ��Al3++3NH3H2O=Al��OH��3��+3NH4+ �� ���Դ��ǣ�Al3++3NH3H2O=Al��OH��3��+3NH4+����4��WΪNH4Cl����������ҺW���Ļ�ѧ����ʽ��2NH4Cl ![]() Cl2��+H2��+2NH3�������Դ��ǣ�2NH4Cl
Cl2��+H2��+2NH3�������Դ��ǣ�2NH4Cl ![]() Cl2��+H2��+2NH3������5��CΪ��������֪C��ȼ����Ϊ285.8kJ/mol������Cȼ������Һ̬���ʵ��Ȼ�ѧ����ʽΪ2H2��g��+O2��g��=2H2O��l������H=��571.6kJ/mol�����Դ��ǣ�2H2��g��+O2��g��=2H2O��l������H=��571.6kJ/mol��
Cl2��+H2��+2NH3������5��CΪ��������֪C��ȼ����Ϊ285.8kJ/mol������Cȼ������Һ̬���ʵ��Ȼ�ѧ����ʽΪ2H2��g��+O2��g��=2H2O��l������H=��571.6kJ/mol�����Դ��ǣ�2H2��g��+O2��g��=2H2O��l������H=��571.6kJ/mol��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ���о�ǰ18��Ԫ��ʱ���֣����Խ������ų���ͼ��ʾ�ġ���ţ����״��ͼ��ÿ����������һ��Ԫ�أ�����O�������Ԫ�أ�����˵���д������
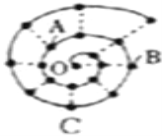
A. O��A��B��C�����γ����ֻ�����
B. AԪ��λ��Ԫ�����ڱ���A��
C. BԪ����ͼ�н�������ǿ��Ԫ��
D. B��C����������ˮ����������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ�صĻ��ϼ��жϣ�����Ԫ�ص���������ֻ����ԭ�����ǣ� ��
A.Na2S
B.S
C.SO2
D.H2SO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ڱ���Ԫ����������ָ��ѧ��ѧ��Ԫ�ؼ��仯����֪ʶ�����۹���,�ش��������⡣
��1������õķǽ���Ԫ����_____(��Ԫ�ط���)��������Ԫ���й���____�ֽ���Ԫ�ء�
��2����Ԫ����Ԫ�����ڱ��е�λ��Ϊ________��
��3����![]() ��ʽ��ʾ��������Ϊ10����ԭ��________��
��ʽ��ʾ��������Ϊ10����ԭ��________��
��4���±�ΪԪ�����ڱ���һ����,�����Ԫ����~���ڱ��е�λ��,�û�ѧ����ش���������:

���١��ڡ���������������Ӧ��ˮ�����������ǿ������˳����______(�û�ѧʽ��ʾ), ���γɵļ��⻯��ĽṹʽΪ_______���������������Ļ�ѧʽ_______���������γɵĺ������ֻ�ѧ�����ʵĵ���ʽΪ________���ܡ�������Ԫ�ص�����������Ӧˮ����֮��ɷ�����Ӧ����Ӧ���ӷ���ʽΪ___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���ˮϡ��0.1molL��l CH3COOH��Һʱ����Һ������ˮ�������Ӷ���С���ǣ� ��
A.![]()
B.![]()
C.c��H+��?c��OH����
D.OH�������ʵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1.0molL��l NaOH��Һ�к�ijŨ��H2SO4��Һʱ����pH������NaOH��Һ�������V����ϵ��ͼ��ʾ����ԭ������Һ�����ʵ���Ũ�Ⱥ�ǡ���к�ʱ��Һ��������ֱ��ǣ������Ϻ���Һ�����Ϊ�������֮�ͣ��� �� 
A.0.5 molL��1��160 mL
B.1.0 molL��1��160 mL
C.0.5 molL��1��80 mL
D.1.0 molL��1��80 mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ�����ר�Һ�°�ġ������Ƽ����Ϊ�����Ƽҵ������ͻ�����ף�����NaCl��NH3��CO2��Ϊԭ�����Ƶ�NaHCO3 �� ��������������йط�Ӧ�Ļ�ѧ����ʽΪ��NH3+CO2+H2O=NH4HCO3��
NH4HCO3+NaCl=NaHCO3��+NH4Cl��
2NaHCO3 ![]() Na2CO3+CO2��+H2O
Na2CO3+CO2��+H2O
��1��̼������뱥��ʳ��ˮ��Ӧ��������̼�����ƾ����ԭ����a��̼������������ˮ
b��̼�����������ֽ�
c��̼�����Ƶ��ܽ����Խ�С����������Һ�����Ƚᾧ����
��2��ij̽���С����������Ƽ�ԭ��������̼�����Ƶ��Ʊ�ʵ�飬ͬѧ�ǰ�������Ƶķ���ʵ�飮��һλͬѧ��������̼����ͨ�뺬���ı���ʳ��ˮ���Ʊ�̼�����ƣ�ʵ��װ������ͼ��ʾ��ͼ�мг֡��̶��õ�����δ��������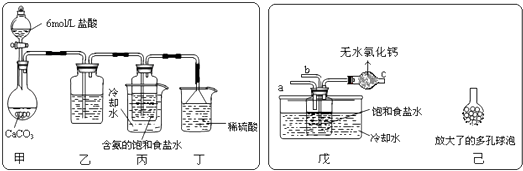
�Իش������й����⣺
������װ���е��Լ�����
����װ����ϡ�������������
����ʵ����������NaHCO3 ����IJ��������������������ƣ���
����һλͬѧ��ͼ����װ�ã�����װ��δ����������ʵ�飮
����ʵ��ʱ�����ȴ���ͨ�����壬�ٴ�����ͨ�����壻
������ͬѧ��������װ�õ�b���¶����Ӽ�װ�ã���������
��3��������д��һ��ʵ������ȡ����̼�����Ƶķ����� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ�ص����ԭ������Ϊ79.904����Ȼ���е��干�������ȶ���ͬλ�أ�����һ��79Br��ԭ�Ӹ����ٷֺ���Ϊ50.7%������һ�����ͬλ�ؿɱ�ʾΪ
A.80BrB.81BrC.82BrD.��ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С�������50mL1.0mol/L�����50mL1.1mol/L����������Һ����ͼװ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ��ش��������⣺ 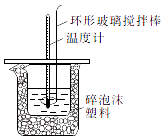
��1�������������������� ��
��2���кͷ�Ӧ�ų���������������������ڷ�Ӧ�лӷ������õ��к��ȵ���ֵ���ƫ����ƫС�����䡱����
��3����ʵ��С����������ʵ�飬ÿ��ȡ��Һ��50mL������ʵ�����ݼ�¼�����
ʵ����� | �� ��ʼ�¶�t1/�� | ��ֹ�¶ȣ�t2���� | �²t2��t1���� | ||
���� | ��NaOH��Һ | ƽ��ֵ | |||
1 | 25.1 | 24.9 | 25.0 | 31.8 | 6.8 |
2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
3 | 25.1 | 25.1 | 25.1 | 32.0 | 6.9 |
��֪���ᡢNaOH��Һ���ܶ���ˮ��ͬ���кͺ����ɵ���Һ�ı�����c=4.18��10��3kJ/��g�棩����÷�Ӧ���к��ȡ�H= ��
��4�����к��Ȳⶨʵ���У�������ʼ�¶�ʱ��Ҫ�����¶ȼƣ����ֻ��һ���¶ȼƲ��������õ��к��ȵ���ֵ���ƫ����ƫС�����䡱����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com