
����Ŀ��Ԫ�����ڱ���Ԫ����������ָ��ѧ��ѧ��Ԫ�ؼ��仯����֪ʶ�����۹���,�ش��������⡣
��1������õķǽ���Ԫ����_____(��Ԫ�ط���)��������Ԫ���й���____�ֽ���Ԫ�ء�
��2����Ԫ����Ԫ�����ڱ��е�λ��Ϊ________��
��3����![]() ��ʽ��ʾ��������Ϊ10����ԭ��________��
��ʽ��ʾ��������Ϊ10����ԭ��________��
��4���±�ΪԪ�����ڱ���һ����,�����Ԫ����~���ڱ��е�λ��,�û�ѧ����ش���������:

���١��ڡ���������������Ӧ��ˮ�����������ǿ������˳����______(�û�ѧʽ��ʾ), ���γɵļ��⻯��ĽṹʽΪ_______���������������Ļ�ѧʽ_______���������γɵĺ������ֻ�ѧ�����ʵĵ���ʽΪ________���ܡ�������Ԫ�ص�����������Ӧˮ����֮��ɷ�����Ӧ����Ӧ���ӷ���ʽΪ___________________��
���𰸡� F 5 �������ڵ�VIA�� ![]() HNO3>H2CO3>H2SiO3 H-O-H Cl2O7
HNO3>H2CO3>H2SiO3 H-O-H Cl2O7 ![]() OH-+Al(OH)3=AlO2-+2H2O
OH-+Al(OH)3=AlO2-+2H2O
��������(1)F�ķǽ�������ǿ������õķǽ���Ԫ����F��������Ԫ���й���ﮡ��롢�ơ�þ����5�ֽ���Ԫ�أ��ʴ�Ϊ��F��5��
(2)��Ϊ16��Ԫ�أ���Ԫ�����ڱ���λ�ڵ������ڵ�VIA�壬�ʴ�Ϊ���������ڵ�VIA����
(3)O��������Ϊ8��������Ϊ10����������Ϊ18������ԭ�ӱ�ʾΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
(4)����Ԫ�������ڱ��е�λ�ÿ�֪����ΪC����ΪN����ΪO����ΪNa����ΪAl����ΪSi����ΪCl��Ԫ�صķǽ�����Խǿ������������Ӧ��ˮ���������Խǿ����������������������Ӧ��ˮ�����������ǿ������˳��ΪHNO3>H2CO3>H2SiO3�����γɵļ��⻯��Ϊˮ���ṹʽΪH-O-H���ߵ����������Ļ�ѧʽΪCl2O7��������γɵĺ������ֻ�ѧ�����ʵ�Ϊ�������ƣ�����ʽΪ![]() ������������Ԫ�ص�����������Ӧˮ����֮��ɷ�����Ӧ����Ӧ���ӷ���ʽΪOH-+Al(OH)3=AlO2-+2H2O���ʴ�Ϊ��HNO3>H2CO3>H2SiO3��H-O-H��Cl2O7��
������������Ԫ�ص�����������Ӧˮ����֮��ɷ�����Ӧ����Ӧ���ӷ���ʽΪOH-+Al(OH)3=AlO2-+2H2O���ʴ�Ϊ��HNO3>H2CO3>H2SiO3��H-O-H��Cl2O7��![]() ��OH-+Al(OH)3=AlO2-+2H2O��
��OH-+Al(OH)3=AlO2-+2H2O��


 �����ܿ����ϵ�д�
�����ܿ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W������һ������,��X+Y=Z+W,��X��Y�ķ�Ӧ��������( )
A.�κ��εķ�ӦB.�����������ˮ�ķ�Ӧ
C.�����ķ�ӦD.����������ͼ�ķ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25��ʱ������Һ��pH
��1��pH=3��������pH=5������������Ϻ�pH=
��2��pH=10��pH=12������NaOH��Һ�������Ϻ�pH=
��3��pH=9��NaOH��Һϡ�͵�ԭ����10����pH= �� ��ϡ�͵�ԭ����1000����pH ��
��4��pH=12��NaOH��pH=4��HCl�������Ϻ�pH= ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���뵼�幤ҵ��ʯӢɰ��ԭ��ͨ��������Ҫ��Ӧ�������ʹ裺
��SiO2��s��+2C��s���TSi��s��+2CO��g����H=+682.44kJmol��1 ��
��ʯӢɰ�� �� ���ֹ裩
��Si��s��+2Cl2��g���TSiCl4��g����H=��657.01kJmol��1
��SiCl4��g��+2Mg��s���T2MgCl2��s��+Si��s����H=��625.63kJmol��1
�����裩
��ʯӢɰ����1.00kg������ܷ���Ϊ�� ��
A.2.43��104 kJ
B.2.35��104 kJ
C.2.23��104 kJ
D.2.14��104 kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijУѧ��Ϊ̽�������巢����Ӧ��ԭ��������ͼװ�ý���ʵ�飮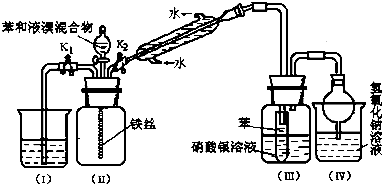
�������֪ʶ�ش��������⣺
��1��ʵ�鿪ʼʱ���ر�K1 �� ����K2�ͷ�Һ©���������μӱ���Һ��Ļ��Һ����Ӧ��ʼ����һ������ڣ����п��ܹ۲쵽��������
��2������ʵ��װ�����ܷ�ֹ������װ��������װ����ţ���
��3����Ӧ������Ҫʹװ�ã�I���е�ˮ������װ�ã����У�����������Ŀ���� �� ������һ��������
��4������Ϊͨ����ʵ����йر����巴Ӧ��ԭ�������ܵó��Ľ����� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һС������Ƴ���¶���ڿ����з���һϵ�б仯�����ղ�����( )
A. NaOH B. Na2CO3 C. Na2CO3��10H2O D. Na2O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ҺW�ĵ����������ϵ�з�Ӧ��ͼ�е�ÿһ�����ʾ�йص�һ����Ҫ��Ӧ����������Ӧ�м�������ɵ�ˮ�Լ����ɵ�������������ȥ��������A��B��C��D��E�ڳ����¾�Ϊ��̬���ʣ�X��K����ѧ�����Ľ������ʣ�������Y��һ�ֱȽϺõ��ͻ���ϣ�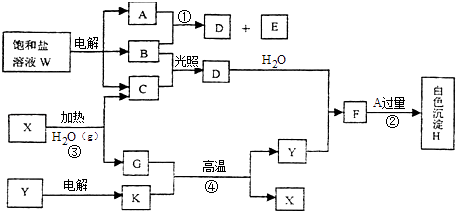
�ش��������⣺
��1��X��Y�Ļ�ѧʽ�ǣ�X �� Y ��
��2��A�ĵ���ʽ�� �� B�ľ��������� ��
��3����Ӧ�ڵ����ӷ���ʽ�� ��
��4����������ҺW���Ļ�ѧ����ʽ�� ��
��5����֪C��ȼ����Ϊ285.8kJ/mol����д��C���û�ѧʽ��ʾ��ȼ������Һ̬���ʵ��Ȼ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ʰ��ᡢ��η���˳�����е��ǣ�������
A. ���ᣨH2SO4�������Na2CO3����ʳ�Σ�NaCl��
B. ���ᣨHNO3�����ռNaOH����������CuSO45H2O��
C. ���ᣨCH3COOH�����Ҵ���C2H5OH���������[(NH4)2SO4]
D. ���ᣨHCl������ʯ��[Ca(OH)2]�������ƣ�NaOH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���㶨�¶�ΪT1��ʱ�����ݻ�Ϊ10L���ܱ������г���1.0mol X��0.80mol Y��������Ӧ��
2X��g��+Y��g��2Z��g����X��ת������ʱ��ı仯��ϵ��ͼ��ʾ��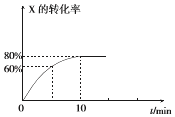
��1����2minʱ�ķ�Ӧ����v1��X��������ڡ�����С�ڡ����ڡ�����8minʱ�ķ�Ӧ���ʿ�v2��X����ԭ���� ��
��2����Ӧ��0��10min��Y��ƽ����Ӧ����v��Y��=molL��1min��l ��
��3��T1���¶��·�Ӧ��ƽ�ⳣ��K1Ϊ �� ���ڵ�10min��ѹ�������ݻ���X��ת���������������С�����䡱����ͬ����ƽ�ⳣ�� ��
��4���������¶ȵ�T2�棨 T2��T1����ƽ��ʱX��ת���ʼ�С����÷�Ӧ�ġ�H0������ڡ���С�ڡ�����
��5�����ı��������ʼ��������£�������θı�������Y��ת����һ��С�� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com