
����Ŀ����(Sb)���仯�����ڹ�ҵ����������;���Ի������Ҫ�ɷ�ΪSb2S3��������PbS��As2S3��CuO��SiO2�ȣ�Ϊԭ���Ʊ�������Ĺ���������ͼ��ʾ��
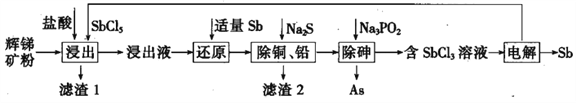
��֪���� ����Һ�г������������SbCl5֮�⣬������SbCl3��PbCl2��AsCl3��CuCl2�ȣ�
�ڳ����£�Ksp(CuS)=1.27��10-36��Ksp(PbS)=9.04��10-29��
����Һ������Ũ��С�ڵ���1.0��10-5mol��L-1ʱ����Ϊ�����ӳ�����ȫ��
��1������1�г���S֮�⣬����___________���ѧʽ����
��2����������ʱ��Sb2S3������Ӧ�Ļ�ѧ����ʽΪ_________________��
��3������ԭ��ʱ����Sb��ԭ������Ϊ_____________���ѧʽ����
��4�������£�����ͭ��Ǧ��ʱ��Cu2+��Pb2+��������ȫ����ʱ��Һ�е�c(S2-)������______������Na2SҲ���˹��࣬��ԭ��Ϊ_____________��
��5�������顱ʱ��H3PO3���ɣ��÷�Ӧ�Ļ�ѧ����ʽΪ________________��
��6������⡱ʱ����������SbԪ���뱻��ԭ��SbԪ�ص�����֮��Ϊ_______��
��7��һ��ͻ�ƴ�ͳ�����������þ-��Һ̬�������ܵ�ع���ԭ����ͼ��ʾ��

�õ�������ܶȵIJ�ͬ�������������·�Ϊ���㣬����ʱ�м�������ε���ɲ��䡣���ʱ��C1-��_____����ϡ����¡����ƶ����ŵ�ʱ�������ĵ缫��ӦʽΪ________��
���𰸡� SiO2 Sb2S3��3SbCl5��5SbCl3��3S SbCl5 9.04��10-24 mol��L��1 ����H2S����Ⱦ�����������Sb2S3 2AsCl3��3Na3PO2��3HCl��3H2O��2As��3H3PO3��9NaCl 3�U2 �� Mg2����2e����Mg
��������(1)��������Ҫ�ɷ�ΪSb2S3��������PbS��As2S3��CuO��SiO2��)���ڼ��������SbCl5���ݽ���Һ�г������������SbCl5֮�⣬������SbCl3��PbCl2��AsCl3��CuCl2����Sb2S3��PbS��As2S3��CuO�����ܽ⣬ֻ��SiO2���ܣ�����1�г���S֮�⣬���ж������裬�ʴ�Ϊ��SiO2��
(2)��������ʱ��Sb2S3��SbCl5����������ԭ��Ӧ����Ӧ�Ļ�ѧ����ʽΪSb2S3��3SbCl5��5SbCl3��3S ���ʴ�Ϊ��Sb2S3��3SbCl5��5SbCl3��3S ��
(3)��������ͼ�ͣ������к�������SbCl5����������ԭ���Ȳ�����õ�SbCl3�����SbCl5��Sb��ԭ���ʴ�Ϊ��SbCl5��
(4)���ݳ����£�Ksp(CuS)=1.27��10-36��Ksp(PbS)=9.04��10-29����Cu2+��Pb2+��������ȫʱ��c(S2-)�ֱ���![]() =1.27��10-31 mol/L��
=1.27��10-31 mol/L��![]() =9.04��10-24 mol/L�����c(S2-)������9.04��10-24 mol/L�������������ܹ���Һ�е��ᷴӦ�ų���Ⱦ���������⣬���������ƻ�����SbCl3���ɳ������������Na2SҲ���˹��࣬�ʴ�Ϊ��9.04��10-24 mol/L������H2S����Ⱦ�����������Sb2S3��
=9.04��10-24 mol/L�����c(S2-)������9.04��10-24 mol/L�������������ܹ���Һ�е��ᷴӦ�ų���Ⱦ���������⣬���������ƻ�����SbCl3���ɳ������������Na2SҲ���˹��࣬�ʴ�Ϊ��9.04��10-24 mol/L������H2S����Ⱦ�����������Sb2S3��
(5)��������ʱ��������As�⣬����H3PO3���ɣ���Ӧ�Ļ�ѧ����ʽΪ2AsCl3��3Na3PO2��3HCl��3H2O��2As��3H3PO3��9NaCl���ʴ�Ϊ��2AsCl3��3Na3PO2��3HCl��3H2O��2As��3H3PO3��9NaCl��
(6)��������ͼ���������ʱ��SbCl3��Ӧ����SbCl5��Sb�����ݻ��ϼ������غ㣬��������SbԪ���뱻��ԭ��SbԪ�ص����ʵ���֮��Ϊ3:2������֮��Ϊ3:2���ʴ�Ϊ��3:2��
(7)�м��������Ϊ�������Һ�����ݵ�������þҺΪ��صĸ��������ʱ��þ��Ϊ�������������������ƶ����������ƶ����ŵ�ʱ��þҺΪ��صĸ������缫��ӦΪMg -2e��=Mg2��������������ԭ��Ӧ���缫��ӦʽΪMg2����2e����Mg���ʴ�Ϊ���£�Mg2����2e����Mg��


 ������ȫ��������ϵ�д�
������ȫ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ƣ�NaNO2����һ�ֳ�����ʳƷ���Ӽ���ʹ��ʱ�����ϸ������������ij��ȤС���������ʵ��̽������������֪����
��2NO+Na2O2=2NaNO2
��2NO2+Na2O2=2NaNO3
������KMnO4��Һ�ɽ�NO2������ΪNO3����MnO4������ԭ��Mn2+��
��Ʒ�Ʊ�����飺��ͼ20װ���Ʊ�NaNO2
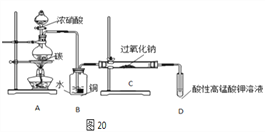
��1��д��װ��A��ƿ�з�����Ӧ�Ļ�ѧ����ʽ________________��
��2��Bװ�õ�������___________��ʢŨ�������������Ϊ__________��
��3����ͬѧ��Ϊװ��C�в��ﲻ�����������ƣ�����̼���ƺ��������ƣ�Ϊ�Ʊ�������NaNO2��Ӧ��B��Cװ�ü�����һ������ܡ��ڸ������ʢ�ŵ��Լ�����Ϊ____________��
��4�������ʵ�飬����װ��C��NaNO2�Ĵ��ڣ�д������������ͽ��ۣ�_________��
�����IJⶨ
��ȡװ��C�з�Ӧ��Ĺ���4.00g����ˮ���250mL��Һ��ȡ25.00mL��Һ����ƿ�У���0.1000mol/L����KMnO4��Һ���еζ���ʵ�������������±���ʾ��
����� | 1 | 2 | 3 | 4 |
KMnO4��Һ���/mL | 20.60 | 20.02 | 20.00 | 19.98 |
��5����һ��ʵ�����ݳ����쳣����������쳣��ԭ�������_________��
A����ʽ�ζ���������ˮϴ����δ�ñ�Һ��ϴ
B����ƿϴ����δ����
C���ζ����������Ӷ���
D���ζ��������Ӷ���
��6�����ݱ������ݣ��������ù������������Ƶ���������_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ������Ȼ��ȴ�������̬�ִ��ڻ���̬���ǣ� ��
A. ��B. ��C. ��D. ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ����480 mL 0.5 mol/L NaOH��Һ��
�� ��ͬѧ��ʵ������У��õ��IJ��������У���Ͳ������������ͷ�ι�___________��
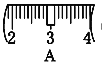
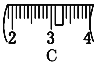
�� �������������ͼ��ʾ�����ͼ����Ӧ����ͼ�е�____(��ѡ����ĸ)֮�䡣
A������� B������� C������� D�������


�� ��ͬѧӦ��ȡNaOH����___g��������Ϊ23.1 g���ձ�����������ƽ�ϳ�ȡ����NaOH����ʱ�����ڸ�����ѡȡ����������С_____(��Сд��ĸ)��
������ͼ��ѡ������ȷ��ʾ����λ�õ�ѡ��____(���д��ĸ)��
������������
a | b | c | d | e | |
�����С/g | 100 | 50 | 20 | 10 | 5 |

�� ��ͬѧʵ������NaOH��Һ��Ũ��Ϊ0.48 mol��L��1��ԭ�������____(�����)��
A������NaOH����ʱ�������ˡ�������� B������ƿ��ԭ����������ˮ
C���ܽ������ձ���Һ��δϴ�� D���ý�ͷ�ιܼ�ˮ����ʱ���ӿ̶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�������ͨ�������²����������ѧ��Ӧ����
A. SO2��H2S B. Cl2��CO2 C. H2��F2 D. NH3��HCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����仯����㷺�ֲ�����Ȼ���У����Ṥҵ�ڹ�����ռ�м�����Ҫ�ĵ�λ���������ԭ���ش��������⣺
��1�����������У����ݻ�ѧƽ��ԭ����ȷ�����������ʩ��_______������ţ���
A����ʯ������ڻ�֮ǰ�ȷ���
B��ʹ��V2O5������
C���Ӵ����в�ʹ�úܸߵ��¶�
D��������¯����Ҫ�й����Ŀ���
E���Ӵ������ڳ�ѹ�½���
��2����ʵ������537�桢1.01��105Pa�ʹ������������£���ij�ܱ������г���2mol SO2��2mol O2����ʱ���Ϊ10L�����¶Ⱥ�ѹǿ����������20���Ӻ�Ӧ�ﵽƽ�⣬SO3�������Ϊ0.5��
�ٸ��¶��£��ӷ�Ӧ��ʼ��ƽ��ʱ������ƽ����Ӧ������_______��
�ڸ��¶��£���Ӧ2SO2(g)+O2(g)![]() 2SO3(g)��ƽ�ⳣ����ֵΪ_______________��
2SO3(g)��ƽ�ⳣ����ֵΪ_______________��
��3����ҵ��ұ��ͭ��Ҫ�Ի�ͭ����Ҫ�ɷ�CuFeS2��Ϊԭ�ϣ��������i��Ӧ��ͭԪ�ػ�ԭΪͭ��������һ��Ϊ��2Cu2S+3O2(g) === 2Cu2O+2SO2���Դӷ�Ӧ���Է����жϴ˷�Ӧ�Ħ�H________0 (�����������������)��
��4���õ��ķ�����������Һ����Ϊ��������о�������Ҫ��ʵ�����壬������ת��Ϊ�������ǵ�ⷨ�������������һ����Ҫ���ݡ���ͼ���ǵ������������ʵ��װ�ã�
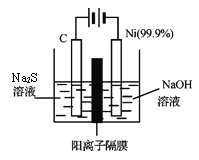
����֪�����ķ�ӦΪ��(x+1)S2��=== Sx+S2��+2xe�����������ĵ缫��Ӧʽ�ǣ�__________������Ӧת��xmol����ʱ���������������Ϊ_________����״���£���
�ڽ�Na2S��9H2O����ˮ������������Һʱ��ͨ�����ڵ����������ܽ⡣��ԭ���ǣ������ӷ���ʽ��ʾ����____________����Һ������Ũ���ɴ�С��˳��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ���üױ��������ǻ��������������£��ش��������⣺
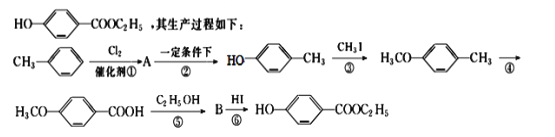
��1���л���A�Ľṹ��ʽΪ________________________________��
��2����Ӧ�ڵķ�Ӧ������_____________����Ӧ�ܵķ�Ӧ������_______________��
��3����Ӧ�۵Ļ�ѧ����ʽ(����д��Ӧ��������Ҫ��ƽ)��____________________��
��4����Ӧ�ݵĻ�ѧ����ʽ(Ҫע����Ӧ����)��____________________________��
��5���ںϳ���·�У���Ƶڢۺ͢���������ӦĿ����_____________________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ɫ����ˮ����ζ��Һ�壬�е�Ϊ77.2�棬ʵ����ij����ȡ���ñ�����14.3mL��95%�Ҵ�23mL�����õ�Ũ���ᡢ����̼�����Լ��������Ҵ���ϳ���ˮ������Ȼ�����Һ����Ҫװ����ͼ��ʾ��

ʵ�鲽�裺
������A�е�������ƿ��ע�������Ҵ���Ũ�����ҡ�ȣ��ٽ�ʣ�µ������Ҵ��ͱ�����ע���Һ©������á���ʱ��Һ©�����������Ҵ������ʵ���֮��ԼΪ5��7��
�ڼ�����ԡ����Լ135 �桫145��
�۽���Һ©���е�Һ�建������������ƿ����ڼ�������ʹ��������������������ʴ�����ȣ�ֱ��������ɡ�
�ܱ�����ԡ�¶�һ��ʱ�䣬��������Һ�������ֹͣ���ȡ�
��ȡ��B�е���ƿ����һ��������Na2CO3��Һ����������εؼӵ����Һ��ӱ����������ݲ���Ϊֹ��
���ݵ�Һ�������Һ����ȥˮ�㡣
�߽�����CaCl2��Һ�����������뵽��Һ©���У���һ��ʱ����ã��ų�ˮ�㣨��Һ����
���Һ©����õ����dz����ᴿ������������Ʒ��
�Իش�
(1)ʵ����Ũ�������Ҫ������_________________________��
(2)�ù����Ҵ�����ҪĿ����____________________________��
(3)�ñ���Na2CO3��Һϴ�Ӵ�����Ŀ����_______________________��
(4)�ñ���CaCl2��Һϴ�Ӵ�����Ŀ����_______________________��
(5)�ڲ�������õĴ����ﻹ���е�������_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڿ��淴Ӧ4NH3(g��+5O2(g��![]() 4NO(g��+6H2O(g��������������ȷ����
4NO(g��+6H2O(g��������������ȷ����
A. �ﵽ��ѧƽ��ʱ��4v��(O2��=5v��(NO��
B. ����λʱ��������x mol NO��ͬʱ������x mol NH3����Ӧ�ﵽƽ��״̬
C. �ﵽ��ѧƽ��ʱ�����������������������Ӧ���ʼ�С���淴Ӧ��������
D. ��ѧ��Ӧ���ʹ�ϵ�ǣ�2v��(NH3��=3v��(H2O��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com