
����Ŀ��ijͬѧ����480 mL 0.5 mol/L NaOH��Һ��
�� ��ͬѧ��ʵ������У��õ��IJ��������У���Ͳ������������ͷ�ι�___________��
�� �������������ͼ��ʾ�����ͼ����Ӧ����ͼ�е�____(��ѡ����ĸ)֮�䡣
A������� B������� C������� D�������


�� ��ͬѧӦ��ȡNaOH����___g��������Ϊ23.1 g���ձ�����������ƽ�ϳ�ȡ����NaOH����ʱ�����ڸ�����ѡȡ����������С_____(��Сд��ĸ)��
������ͼ��ѡ������ȷ��ʾ����λ�õ�ѡ��____(���д��ĸ)��
������������
a | b | c | d | e | |
�����С/g | 100 | 50 | 20 | 10 | 5 |
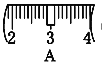

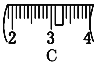
�� ��ͬѧʵ������NaOH��Һ��Ũ��Ϊ0.48 mol��L��1��ԭ�������____(�����)��
A������NaOH����ʱ�������ˡ�������� B������ƿ��ԭ����������ˮ
C���ܽ������ձ���Һ��δϴ�� D���ý�ͷ�ιܼ�ˮ����ʱ���ӿ̶�
���𰸡� �ձ���500mL����ƿ C 10.0 cd C ACD
����������1��ʵ����û��480mL������ƿ������ʱӦ��ѡ��500mL������ƿ�����Ʋ����У����㡢�������ܽ⡢��Һ��ϴ�ӡ����ݡ�ҡ�ȵȲ�����һ����������ƽ��������ҩ��ȡ��ҩƷ�����ձ����ܽ⣬��ȴ��ת�Ƶ�500mL����ƿ�У����ò���������������ˮ��Һ�����̶���1��2cmʱ�����ý�ͷ�ιܵμӣ�������Ҫ������Ϊ��������ƽ��ҩ�ס��ձ�����������500mL����ƿ����ͷ�ιܣ����Ի�ȱ��500mL����ƿ���ձ�����2���������������ͼ��ʾ����ͼ��������������ƿ�еμ�����ˮ������Ӧ�ڶ���֮ǰ������ͼ�еĢ����֮�䣬��ѡC����3����ͬѧӦ��ȡNaOH����������0.5L��0.5mol/L��40g/mol��10.0g��������Ϊ23.1 g���ձ�����������ƽ�ϳ�ȡ����NaOH����ʱ����Ҫ����������30g�������ƶ���3.1g�������Ը��ݱ������ݿ�֪ѡȡ����������Сc��d������ȷ��ʾ����λ�õ�ѡ����C����4����ͬѧʵ������NaOH��Һ��Ũ��Ϊ0.48 mol��L��1����Ũ��ƫ�͡���A������NaOH����ʱ�������ˡ�������������³������������Ƶ�����ƫС�����Ƶ���Һ���������Ƶ����ʵ���ƫС����ҺŨ��ƫ�ͣ�A��ȷ��B������ƿ��ԭ����������ˮ�������ʵ����ʵ�������Һ�������û��Ӱ�죬���Բ�Ӱ�����ƽ����B����C���ܽ������ձ���Һ��δϴ�ӣ��������Ƶ���Һ�������������Ƶ����ʵ���ƫС�����Ƶ���ҺŨ��ƫ�ͣ�C��ȷ��D���ý�ͷ�ιܼ�ˮ����ʱ���ӿ̶ȣ���������ʱ���������ˮ���ƫ�����Ƶ���ҺŨ��ƫ�ͣ�D��ȷ����ѡACD��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ���Ũ��Ϊ0��1molL��1��Na2CO3��Һ100 mLʱ�����в�����ȷ����
A. ��������ƽ��ȡ1��06 g ��ˮ̼���ƣ����ձ��м�����ˮ�ܽ⣬����ȴ�����º���Һת�Ƶ�����ƿ��
B. ��ʹ������ƿǰ����������ƿ�Ƿ�����Լ�ƿ�����Ƿ�©ˮ
C. ����ʱ������ˮ�����̶��ߣ����ý�ͷ�ι�С���������ಿ��
D. ����ʱ�������ӣ���������Һ��Ũ�Ƚ�ƫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں��ݾ����ܱ������У�����2NO2![]() N2O4 (����ӦΪ���ȷ�Ӧ)������˵������֤���÷�Ӧ�ﵽƽ��״̬����
N2O4 (����ӦΪ���ȷ�Ӧ)������˵������֤���÷�Ӧ�ﵽƽ��״̬����
A. ��ϵ�¶Ȳ��ٸı��״̬ B. ��ϵ�ܶȲ��ٸı��״̬
C. ��ϵ�������ƽ��Ħ���������ٸı��״̬ D. ��ϵѹǿ���ٸı��״̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����12�֣���Դ��ȱ������������ٵ��ش����⡣�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����
��1����ҵ�Ϻϳɼ״��ķ�Ӧԭ��Ϊ��CO(g)��2H2(g)![]() CH3OH(g) ��H���±����������Ǹ÷�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K����
CH3OH(g) ��H���±����������Ǹ÷�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K����
�¶� | 250�� | 300�� | 350�� |
K | 2.041 | 0.270 | 0.012 |
�ٸ��ݱ������ݿ��жϦ�H 0 �����������������������
����300��ʱ����2 mol CO��3 mol H2��2 mol CH3OH�����ݻ�Ϊ1L���ܱ������У���ʱ��Ӧ�� ���������Ӧ������С��������淴Ӧ������С�����ƽ��״̬������
��2���Լ״�������Ϊԭ����KOH��Һ��Ϊ����ʹ���ȼ�ϵ���ܷ�ӦΪ��2CH3OH+3O2+4OH-=2CO32-+6H2O�����ĵ缫��ӦʽΪ�� �����ŷ�Ӧ�IJ��Ͻ�����Һ��pH (�������С�����䡱)��
��3������Ը�ȼ�ϵ��Ϊ��Դ��ʯī��������ⱥ��ʳ��ˮ����õ������������ĵ缫��ӦʽΪ�� ��������һ��ʱ���NaCl��Һ�����Ϊ1L����Һ��pHΪ12��25���²ⶨ�������������������������Ϊ mL������£���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ�뼼�����ۺ��Ȼ�������Ļ�ѧʽΪ[Al2(OH)nCl6-n��xH2O]m������һ�ָ�Ч��ˮ�������������Ʊ�ԭ���ǵ�������AlCl3��Һ��pH��ͨ���ٽ���ˮ����ᾧ���������Ʊ�ԭ����Ҫ�����ӹ���ҵ�ķ����������ң�����Ҫ��Al2O3��Al������SiO2�����ʡ��ۺ��Ȼ��������Ĺ����������£�

��1��������Ȳ��������з�����Ӧ�����ӷ���ʽ ��
��2�����������в���B��D�����ƾ�Ϊ ��B��DΪ��������
��3����Ӧ�и���Ʒa�� ���û�ѧʽ��ʾ����
��4�����������п�ѭ��ʹ�õ������� ���û�ѧʽ��ʾ����
��5������pH��4.0~4.5��Ŀ���� ��
��6��ʵ����Ҫ�ⶨˮ��������Ʒ��n��x��ֵ��Ϊʹ�ⶨ�����ȷ����õ��ľ���ϴ���������������C���ʿ�ѡ�� ��
A��NaOH | B��Al | C����ˮ | D��Al2O3E��NaAlO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯������������������;�㷺����ش�
I.�����������£������е�NH4+���ձ�O2����ΪNO3-���÷�Ӧ�����ӷ���ʽΪ________��
��.��������Ҫ�Ļ���ԭ�ϡ���֪��25��ʱ��NH3��H2O�ĵ��볣��kb=1.79��10-5�����¶��£�1.79mol/LNH4Cl��Һ��pHԼΪ_____________��
��.��������ʻ�����������·�Ӧ������
��.N2(g)+O2(g)![]() 2NO(g) ��H=+180.7kJ/mol
2NO(g) ��H=+180.7kJ/mol
��.2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ��H=-746.5kJ/mol
N2(g)+2CO2(g) ��H=-746.5kJ/mol
��1���ܱ�ʾCOȼ���ȵ��Ȼ�ѧ����ʽΪ__________________��
��2����Ӧ����________����ϸߡ��ϵ͡����¶������Է����С�
��3��T�¶�ʱ����10L�����ܱ������г���2molNO��2molCO������Ӧii��5minʱ�ﵽƽ�⣬���0��5min�ڸ÷�Ӧ����v(N2)=0.016mol��L-1��min-1��
��T�¶�ʱ���÷�Ӧ��ƽ�ⳣ��K=____________________��
��ƽ��ʱ������ѹǿ����ʼʱ������ѹǿ֮��Ϊ_________________��
��4��һ�������£�����ʼ�ݻ�Ϊ5L�ĺ�ѹ�ܱ���������1molN2��1molO2������Ӧi��O2��ƽ��ת����(��)���¶�(T)�Ĺ�ϵ��ͼ1��ʾ������Ӧ��ƽ�ⳣ��(K)���¶�(T)�Ĺ�ϵ��ͼ2��ʾ��
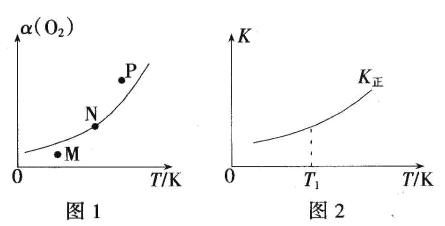
��ͼ1�У�M��N��P��������Ӧ��״̬�£�v(��)>v(��)����_______(����ĸ)������Ϊ______��
��T1�¶�ʱ��K��=1����O2��ƽ��ת����Ϊ________(������λ��Ч����)����ͼ2�л����淴Ӧƽ�ⳣ����K�������¶�(T)�Ĺ�ϵ���ߡ�________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����(Sb)���仯�����ڹ�ҵ����������;���Ի������Ҫ�ɷ�ΪSb2S3��������PbS��As2S3��CuO��SiO2�ȣ�Ϊԭ���Ʊ�������Ĺ���������ͼ��ʾ��
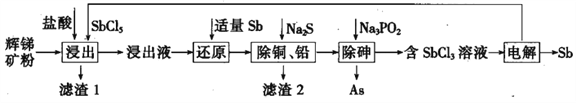
��֪���� ����Һ�г������������SbCl5֮�⣬������SbCl3��PbCl2��AsCl3��CuCl2�ȣ�
�ڳ����£�Ksp(CuS)=1.27��10-36��Ksp(PbS)=9.04��10-29��
����Һ������Ũ��С�ڵ���1.0��10-5mol��L-1ʱ����Ϊ�����ӳ�����ȫ��
��1������1�г���S֮�⣬����___________���ѧʽ����
��2����������ʱ��Sb2S3������Ӧ�Ļ�ѧ����ʽΪ_________________��
��3������ԭ��ʱ����Sb��ԭ������Ϊ_____________���ѧʽ����
��4�������£�����ͭ��Ǧ��ʱ��Cu2+��Pb2+��������ȫ����ʱ��Һ�е�c(S2-)������______������Na2SҲ���˹��࣬��ԭ��Ϊ_____________��
��5�������顱ʱ��H3PO3���ɣ��÷�Ӧ�Ļ�ѧ����ʽΪ________________��
��6������⡱ʱ����������SbԪ���뱻��ԭ��SbԪ�ص�����֮��Ϊ_______��
��7��һ��ͻ�ƴ�ͳ�����������þ-��Һ̬�������ܵ�ع���ԭ����ͼ��ʾ��

�õ�������ܶȵIJ�ͬ�������������·�Ϊ���㣬����ʱ�м�������ε���ɲ��䡣���ʱ��C1-��_____����ϡ����¡����ƶ����ŵ�ʱ�������ĵ缫��ӦʽΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͬ��ͬѹ�£���������������ڷֱ������![]() N��l3C��18O����ԭ�ӹ��ɵ�һ��������һ����̼������˵����ȷ����
N��l3C��18O����ԭ�ӹ��ɵ�һ��������һ����̼������˵����ȷ����
A. ����������������������ͬ B. ������ͬ�ķ������͵�����
C. ������ͬ���������������� D. ������ͬ��Ŀ�����ӡ�ԭ�Ӻͷ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ư����Һ���ݹ�����ɫ����������ɹ�ڿ���������һ��ʱ������Ư��Ч�����õ�ԭ������
A. Ư�۱�������
B. Ư�ۺͿ����еĶ�����̼��ַ�Ӧ�����˴�����
C. ��ɫ�����������е���������
D. Ư����Һʧȥ�˲���ˮ����Ũ��������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com