
| A、金属性:B>A>C>D |
| B、原子半径:B>A>C>D |
| C、元素的电负性:D>C>B>A |
| D、离子半径:C3->D->B+>A2+ |


科目:高中化学 来源: 题型:
| A、铜铸塑像上出现铜绿[Cu2(OH)2CO3] |
| B、雷雨发庄稼 |
| C、用铝质或铁质容器盛放浓硝酸 |
| D、用石膏粉制作石膏雕像 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、9g H2O和0.5mol Br2中所含的原子数 |
| B、0.5mol Na2SO4和1L 0.5 mol/L的NaOH溶液中所含的Na+ |
| C、2240mLCO(标准状况)和0.1mol N2中所含的原子数 |
| D、5.6L氮气(标准状况)和22gCO2所含的分子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
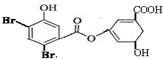 已知,某有机物其结构如图所示,关于该物质的说法正确的是( )
已知,某有机物其结构如图所示,关于该物质的说法正确的是( )| A、1mol该物质最多消耗NaOH为7mol |
| B、滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键 |
| C、该物质与苯酚属于同系物,遇FeCl3溶液呈紫色 |
| D、可与NaHCO3溶液反应放出CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| CH4 | C2H4 | C3H8 | C4H8 | C6H12 | C7H16 | C8H16 |
| A、6 | B、7 | C、8 | D、9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、放热反应都是自发的,吸热反应都是非自发的 |
| B、自发反应一定是熵增大,非自发反应一定是熵减少 |
| C、自发反应在恰当条件下才能实现 |
| D、自发反应在任何条件下都能实现 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两个反应电子转移的数目相等 |
| B、加入镁、铝质量比为4:3 |
| C、金属溶解的物质的量相等 |
| D、加入的两种金属质量不等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
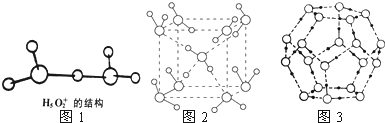
| 2 |
| 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com