
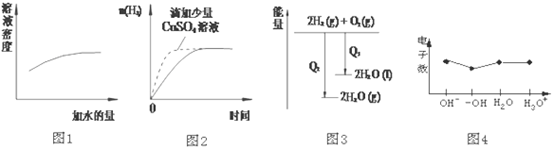
| A. | 图1表示浓硫酸的稀释 | |
| B. | 图2表示过量的盐酸与等量的锌粉反应 | |
| C. | 图3表示氢气与氧气反应中的能量变化 | |
| D. | 图4表示微粒电子数 |
分析 A、浓硫酸加水稀释密度减小;
B、形成原电池可加快化学反应速率,氢气的质量由锌粉的质量决定;
C、物质的燃烧是放热的,液态水变为气态水需要吸收热量;
D、原子的电子数等于质子数;阴离子中,电子数=质子数+电荷数,阳离子中,电子数=质子数-电荷数,以此来分析解答.
解答 解:A、浓硫酸加水稀释密度减小,图象与实际不相符,故A错误;
B、锌粉与硫酸铜反应生成了铜,消耗了锌粉,锌粉、铜和盐酸构成了原电池,加快了化学反应速率,但产生的氢气减少,图象与实际不相符,故B错误;
C、氢气的燃烧是放热的,但是液态水变为气态水需要吸收热量,所以氢气燃烧生成液态水放出的热量多,故C错误;
D、原子的电子数等于质子数;阴离子中,电子数=质子数+电荷数,阳离子中,电子数=质子数-电荷数,则OH-含有10个电子,-OH含有9个电子,H2O含10个电子,H3O+含有10 个电子,与图象一致,故D正确.
故选D.
点评 本题考查了硫酸的密度、原电池原理的应用、反应热、微粒电子数的求算等知识,属于综合知识的考查,侧重于基础知识的应用的考查,难度中等.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
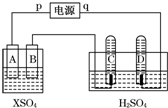 如图,p、q为直流电源两极,A为+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D产生气泡.试回答:
如图,p、q为直流电源两极,A为+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D产生气泡.试回答:| 时间(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 阴极生成气体 体积(cm3) | 6 | 12 | 20 | 29 | 39 | 49 | 59 | 69 | 79 | 89 |
| 阳极生成气体 | 2 | 4 | 7 | 11 | 16 | 21 | 26 | 31 | 36 | 41 |
| 体积(cm3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,44 g CO2气体中含有的碳原子数为nA | |
| B. | 常温常压下,11.2 L 氯化氢气体中含有的分子数为0.5nA | |
| C. | 1 mol铁与足量的稀硫酸完全反应转移的电子数为3nA | |
| D. | 1 L 1 mol•L-1 CuCl2溶液中含有的氯离子数为nA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | |
| B. | CH2═CH-CH═CH2+2H2$→_{△}^{催化剂}$CH3-CH2-CH2-CH3 | |
| C. |  | |
| D. | CH3-CH2Br+NaOH$→_{△}^{H_{2}O}$CH3-CH2OH+NaBr |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com