

分析 (1)根据蒸馏操作装置写出使用的玻璃仪器名称;
(2)①在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,离子浓度大的为浓水,离子浓度小的为淡水;海水中的SO42-、Ca2+、Mg2+,用氢氧化钠除去镁离子,加过量的氯化钡除去硫酸根离子,然后用碳酸钠去除过量的钡离子;
②根据图知,用氯化钠溶液电解得到NaOH、氯气、氢气,氢氧化钠和二氧化硫反应生成亚硫酸钠和水,亚硫酸钠和稀盐酸反应生成氯化钠,能循环利用的物质是氯化钠,所以A为氢氧化钠,BC为氢气和氯气,两者反应生成D为氯化氢,C为亚硫酸钠,据此分析解答;
(3)氯化镁水解显酸性,氯化氢气流中加热防止水解;MgO熔点很高,能耗太大,不经济;
(4)依据题干信息分析,结合离子交换原理回答.
解答 解:(1)需要使用的玻璃仪器为:酒精灯、蒸馏烧瓶、温度计、冷凝管、尾接管、锥形瓶,还缺少蒸馏烧瓶、冷凝管,
故答案为:蒸馏烧瓶、冷凝管;
(2)①分析装置图,阴极室电极和电源负极相连,a为电源负极;在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,a室离子浓度变小,b室离子浓度变大,离子浓度大的为浓水,所以淡水从a处流出,海水中的SO42-、Ca2+、Mg2+,用氢氧化钠除去镁离子,加过量的氯化钡除去硫酸根离子,然后用碳酸钠去除过量的钡离子,所以药品加入顺序次依是NaOH、BaCl2、Na2CO3,
故答案为:?a;BaCl2、Na2CO3;
②用氯化钠溶液电解得到NaOH、氯气、氢气,反应为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,所以A为氢氧化钠,氢氧化钠和二氧化硫反应2NaOH+SO2=Na2SO3+H2O,BC为氢气和氯气,两者反应生成D为氯化氢,氯化氢和亚硫酸钠反应生成二氧化硫,同时回收氯化钠,
故答案为:?2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;2NaOH+SO2=Na2SO3+H2O;
(3)氯化镁水解显酸性,其水解的离子方程式为Mg2++2H2O?Mg(OH)2+2H+,氯化氢气流中中或加入浓盐酸加热,可抑制Mg2+水解,因为MgO熔点很高,能耗太大,增加生产成本,不经济,所以利用氯化镁冶炼金属镁而不利用氧化镁,
故答案为:?HCl气流中; 抑制MgCl2水解;?MgO熔点高,熔融时因耗费大量的能量而增加生产成本;
(4)螫合型离子交换树脂,它专门吸附海水中的U4+,即4HR+U4+=UR4+4H+,发生离子交换后的离子交换膜用酸处理还可再生并得到含铀的溶液,即UR4+4H+=4HR+U4,
故答案为:4HR+U4+=UR4+4H+;UR4+4H+=4HR+U4.
点评 本题考查了海水淡化原理,明确图片内涵是解本题关键,注意电解、盐类水解原理、实验基本操作的灵活应用,题目难度中等.


科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Si、P、S、Cl元素的单质与氢气化合越来越容易 | |
| B. | 非金属元素的非金属性越强,其氧化物对应水化物的酸性也一定越强 | |
| C. | 元素原子最外层电子数越多,元素金属性越强 | |
| D. | F-、O2-、Mg2+、Na+离子半径逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解饱和氯化钠溶液:2Cl-+2H+═H2↑+Cl2↑ | |
| B. | 用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2++2OH-→CH3COO-+NH4++3NH3+2Aɡ↓+H2O | |
| C. | 向沸水中滴加FeCl3溶液制备胶体:Fe3++3H2O═Fe(OH)3↓+3H+ | |
| D. | 将Cl2溶于水中:Cl2+H2O═Cl-+2H++ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0Ll.0mol.L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 丙烯和环丙烷组成的42g混合气体中氢原子的个数为6NA | |
| C. | 25C时pH=11的Na2C03溶液中水电离出的OH-的数目为0.001NA | |
| D. | 氧原子总数为0.2NA的S02和O2的混合气体,其体积为2.24L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
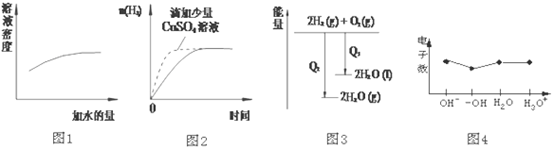
| A. | 图1表示浓硫酸的稀释 | |
| B. | 图2表示过量的盐酸与等量的锌粉反应 | |
| C. | 图3表示氢气与氧气反应中的能量变化 | |
| D. | 图4表示微粒电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 结论 |
| 在一杯浑浊的水中加 少量Al2(SO4)3静置 | 烧杯中的水变澄清 | Al2(SO4)3可 以净水 |
| 在一杯浑浊的水中加 少量KCl,静置 | 烧杯中的水 仍然浑浊 | K+不能起净水作用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com