
现有A、B、C、D四种元素,A元素形成的—2价阴离子比氦原子的核外电子数多8个,B元素与A元素可组成一种化合物E,为淡黄色固体,该固体遇到空气能生成A的单质;C为原子核内有12个中子的金属元素,当2.4gC与足量热水反应时,在标准状况下放出气体2.24L,C形成正二价阳离子;D元素原子的M层上有7个电子。
(1)写出B、C两种元素的元素名称:B ,C ,指出D在周期表中的位置 。
(2)D的气态氢化物与H2S、HF的稳定性由强到弱为 (用化学式表示)。
(3)写出淡黄色固体E的电子式 ,其中含有的化学键为 。
(4)钾元素与B元素位于同一主族,钾元素与A元素可形成K2A、K2A2、KA2等多种化合物,其中K2A2和KA2和CO2均可发生反应(反应与淡黄色固体E和CO2的反应类似),写出KA2与CO2发生反应的化学方程式 。K2A2、KA2在医院、矿井、潜水、高空飞行中常用作供氧剂,为了维持气压稳定可以使用过氧化钾和超氧化钾的混合物使吸收的CO2与生成的O2体积相同(同温同压),则它
们的物质的量之比为 。
(1)B:钠; C:镁; 第三周期第ⅦA族; (2)HF > HCl > H2S ;
(3)Na2O2的电子式 ; 离子键、非极性键(或共价键);
; 离子键、非极性键(或共价键);
(4)4KO2 + 2CO2 =2K2CO3 + 3O2; 1:2
解析试题分析:A元素形成的—2价阴离子比氦原子的核外电子数多8个,则A是8号元素O;B元素与A元素可组成一种化合物E,为淡黄色固体,该固体遇到空气能生成A的单质,则B为Na元素;C为原子核内有12个中子的金属元素,当2.4gC与足量热水反应时,在标准状况下放出气体2.24L,C形成正二价阳离子;则C为Mg元素;D元素原子的M层上有7个电子。则D为Cl元素。(1)B、C两种元素的元素名称分别是B:钠;C:镁。Cl元素在周期表中的位置是位于第三周期第ⅦA族。(2)Cl、S是同一周期的元素,元素的非金属性Cl>S。元素的非金属性越强,其气态氢化物的稳定性就越强。所以气态氢化物HC>H2S;F、Cl是同一主族的元素。从上到下,元素的原子半径逐渐增大,元素的非金属性逐渐减弱。所以氢化物的稳定性HF >HCl。所以这些元素的氢化物稳定性由强到弱为HF > HCl > H2S。(3)淡黄色固体Na2O2的电子式为: 。Na2O2是离子化合物。在Na与O之间以离子键结合,在O、O之间以非极性共价键结合。所以Na2O2中含有的化学键为离子键、非极性键。(4)KO2与CO2发生反应的化学方程式为4KO2 + 2CO2 =2K2CO3 + 3O2;K2O2与CO2反应的方程式为:2K2O2 + 2CO2 =2K2CO3 + O2。若使吸收的CO2与生成的O2体积相同,则n(K2O2):n(KO2)=1:2.
。Na2O2是离子化合物。在Na与O之间以离子键结合,在O、O之间以非极性共价键结合。所以Na2O2中含有的化学键为离子键、非极性键。(4)KO2与CO2发生反应的化学方程式为4KO2 + 2CO2 =2K2CO3 + 3O2;K2O2与CO2反应的方程式为:2K2O2 + 2CO2 =2K2CO3 + O2。若使吸收的CO2与生成的O2体积相同,则n(K2O2):n(KO2)=1:2.
考点:考查元素的推断、元素的金属性、非金属性的比较、物质的电子式、化学键、化学方程式的书写及混合物中组成成分含量的计算的知识。


科目:高中化学 来源: 题型:填空题
(12分)【化学——物质结构与性质】
(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)和Fe(CO)x等。
①基态Fe3+的M层电子排布式为 ;
②尿素(H2NCONH2)分子中C原子的杂化方式是 ;
③配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x= 。
Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型)。
(2)下列说法正确的是 (填字母序号)。
| A.第一电离能大小:S>P>Si |
| B.电负性顺序:C<N<O<F |
| C.因为晶格能CaO比KCl高,所以KCl的熔点比CaO熔点低 |
| D.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高 |
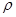 g·cm-3,阿伏加德罗常数为NA,求晶胞边长a= cm。(用含
g·cm-3,阿伏加德罗常数为NA,求晶胞边长a= cm。(用含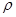 、NA的计算式表示)
、NA的计算式表示)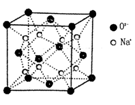
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素。它们之间的关系如下:
(Ⅰ)原子半径:A < C < B < E < D
(Ⅱ)原子的最外层电子数:A = D, C = E, A+B = C。
(Ⅲ)原子的核外电子层数:B = C = 2A
(Ⅳ)B元素的主要化合价:最高正价+最低负价 = 2
(Ⅴ)F的单质或合金是用量最大的金属材料。
请回答:(1)甲由A、B两种元素按原子数之比为3:1组成的物质,写出其电子式 ;
(2)写出某含F黑色的磁性氧化物与B最高价氧化物对应水化物的稀溶液反应的离子方程式: 。
(3)由A、C、E三种元素组成的两种气体化合物,相互反应能生成淡黄色固体的化学反应方程式为: 。
(4)上述元素中A、B、C、E、F的五种元素可形成一种常见复盐,经检测该复盐由三种离子组成且离子个数比为1:1:2,向该盐溶液加入酸化的BaCl2溶液,产生白色沉淀;加入NaOH溶液并加热,产生能使湿润红色石蕊试纸变蓝的气体,则该复盐的化学式为 。为检验该复盐中的某种有色离子存在,请写出实验的操作步骤和现象 ;
(5)将上述复盐配成0.1L 0.1mol/L的溶液,向其中加入0.06mol的BaCl2固体完全反应后,该溶液中c(SO42-)为: (已知:忽略溶液体积变化。该沉淀的Ksp=2×10-9)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
I.用元素符号回答原子序数11-18的元素的有关问题:(填对应物质的化学式)
(1)最高价氧化物的水化物碱性最强的是 ;其电子式为:
(2)最高价氧化物的水化物呈两性的是 ;
(3)能形成气态氢化物且最稳定的是 ,其电子式为 .
II.化学是一门以实验为基础的自然科学,根据已有实验知识回答下列问题。
下列说法错误的是 。
| A.将Cl2通入紫色石蕊试液,溶液先变红后褪色 |
| B.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| C.配制1L0.5mol·L-1的NaCl溶液,需用托盘天秤称量29.25gNaCl固体 |
| D.常温下,可以用铁质容器储运浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
V、W、X、Y、Z是原子序数依次递减的五种常见元素。X元素是地壳中含量最多的元素,Y、Z组成的气态化合物M的水溶液呈碱性,W的单质在X2中燃烧产物可使品红溶液褪色,V是一种历史悠久、应用广泛的金属元素。请回答:
(1)Y元素在周期表中的位置是 ;写出X、Z两种元素组成的化合物Z2X2的一种用途: 。
(2)由以上五种元素两两组合所形成的化合物中,有一种物质能与水反应生成气体且反应属于氧化还原反应,请写出该反应的化学方程式 。
(3)X、Y、Z三种元素可组成一种强酸U,M在适当条件下被U吸收生成一种盐。该盐的水溶液的pH 7(填“大于”、“小于”或“等于”)。原因是(用离子方程式表示)
(4)若将V金属投入到盐酸中,生成了浅绿色溶液N。N的酸性溶液与双氧水反应的离子方程式:
(5)有人设想寻求合适的催化剂和电极材料,以Y2、Z2为电极反应物,以HCl—NH4Cl溶液为电解质溶液制造新型燃料电池,试写出该电池的正极电极反应式 ;放电时溶液中H+移向 (填“正”或“负”)极。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子; B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)A为 ,B为 ,C为 ,D的最高价氧化物的水化物是 。
(2)写出A、B的化合物与E反应的化学方程式: _______________。
(3)A、B两元素形成化合物属 (“离子”或“共价”)化合物。
(4)写出D的最高价氧化物的水化物和A反应的化学方程式: ________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D 4种元素的原子序数均小于18,其最高正价依次为+1、+4、+5、+7,已知B的原子核外次外层电子数为2。A、C原子的核外次外层电子数为8。D元素的最高价氧化物对应水化物是已知无机含氧酸中最强的酸。则:
(1)A、B、C、D分别是 、 、 、
(2)A的离子结构示意图为 ,C的原子结构示意图为
(3)C的最高价氧化物对应水化物与A的氢氧化物反应生成 种盐,其化学式为 、 、 (可不填满,也可补充)
(4)C、D的气态氢化物稳定性由强到弱的顺序是
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
据报道,某些花岗岩会产生放射性的氡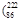 Rn),从而对人体产生伤害。请回答:
Rn),从而对人体产生伤害。请回答:
(1)该原子的质量数是 ,质子数是 ,中子数是 。
(2)请将以下Rn的原子结构示意图补全。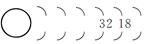
(3)请根据Rn的原子结构预测氡气的化学性质:
A.非常活泼,容易与氧气等非金属单质反应
B.比较活泼,能与钠等金属反应
C.不太活泼,与氮气性质相似
D.很难与其他物质发生反应
你选择 选项,理由是 。
(4)研究发现,镭能衰变为 Rn,故称
Rn,故称 Rn为镭射气;钍能衰变为
Rn为镭射气;钍能衰变为 Rn,故将
Rn,故将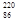 Rn称为钍射气;锕能衰变为
Rn称为钍射气;锕能衰变为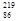 Rn,故将
Rn,故将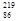 Rn称为锕射气
Rn称为锕射气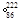 Rn
Rn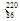 Rn
Rn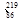 Rn是 (填字母序号)。
Rn是 (填字母序号)。
A.同种元素 B.同位素
C.同种核素 D.同种原子
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。请回答:
(1)用化学符号表示四种微粒:A________,B________,C________,D________。
(2)写出A、B、E三种微粒反应的离子方程式:____________________________________________________。
Ⅱ.(1)CH3+、CH3-、CH3-都是重要的有机反应中间体,它们的电子式分别是________、________、________;其中CH3+中四个原子是共平面的,三个键角相等,则键角应是________。
(2)叠氮化合物在化学工业上有重要应用。N3-叫做叠氮离子,请写出由三个原子构成的含有与N3-的电子数相同的粒子的化学式(3种)________、______、_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com