
I.用元素符号回答原子序数11-18的元素的有关问题:(填对应物质的化学式)
(1)最高价氧化物的水化物碱性最强的是 ;其电子式为:
(2)最高价氧化物的水化物呈两性的是 ;
(3)能形成气态氢化物且最稳定的是 ,其电子式为 .
II.化学是一门以实验为基础的自然科学,根据已有实验知识回答下列问题。
下列说法错误的是 。
| A.将Cl2通入紫色石蕊试液,溶液先变红后褪色 |
| B.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| C.配制1L0.5mol·L-1的NaCl溶液,需用托盘天秤称量29.25gNaCl固体 |
| D.常温下,可以用铁质容器储运浓硝酸 |
I.(1)NaOH,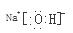
(2) Al(OH)3
(3)HCl,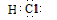
II.C E G
解析试题分析:I.(1)原子序数11-18的元素中金属性最强的元素是Na,其最高价氧化物的水化物碱性最强,化学式为NaOH,电子式为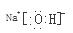 ;
;
(2)原子序数11-18的元素中Al的最高价氧化物的水化物呈两性,是Al(OH)3
(3)原子序数11-18的元素中Cl元素的非金属性最强,气态氢化物最稳定,化学式为HCl,电子式为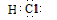 ;
;
II.A、氯气溶于水显酸性,石蕊试液变红,同时有次氯酸生成,所以又褪色,正确;B、分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出,正确;C、托盘天秤称量固体时只能精确到0.1g,错误;D、常温下,铁与浓硫酸发生钝化,反应停止,正确;E、氯化铵分解产生氨气和氯化氢气体,遇冷又结合成氯化铵,得不到氨气,错误;F、硫酸亚铁空气中被氧化为硫酸铁,所以需在试剂瓶内加入铁粉或铁钉,防止硫酸亚铁被氧化,正确;G、除去KCl溶液中少量MgCl2:加入适量NaOH溶液,除去了镁离子,同时又增加了钠离子,错误,答案选C、E、G。
考点:考查11到18号元素的性质,实验操作、实验现象、物质除杂的判断


科目:高中化学 来源: 题型:填空题
(14分)(Ⅰ)、A、B、C、D、E、五种元素均是短周期元素,且原子序数依次增大。B、E原子的最外层电子数均为其电子层数的2倍。D、E元素原子的最外层电子数相等。X、Y、Z、W、G、甲、乙七种物质均由上述中的两种或三种元素组成。元素B形成的单质M与甲、乙(相对分子质量:甲<乙)浓溶液的反应分别是:甲与M反应生成X、Y、Z,乙与M反应生成Y、Z、W,反应条件均省略。回答下列有关问题:
⑴X、Y、W均能与Z反应,若将标准状况下的X和D2按4:1充满试管后将其倒立于水槽中,待水不在上升时,试管内溶质的物质的量浓度是 (假设溶质不扩散)
⑵若将X、W、D2按4:4:3通入Z中充分反应,写出总的离子方程式
⑶G是一种既能与强酸又能与强碱反应的酸式盐,则G的电子式 ,取0.2mol/L的NaOH溶液与0.1mol/L的G溶液等体积混合后,加热至充分反应后,待恢复至室温剩余溶液中离子浓度的由大到小顺序是 ,此时测得溶液的PH=12,则此条件下G中阴离子的电离平衡常数Ka =
(Ⅱ)⑷某温度时,向AgNO3溶液中加入K2CrO4溶液会生成
Ag2CrO4沉淀,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。
该温度下,下列说法正确的是_________。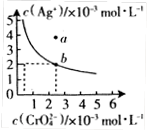
A. Ag2CrO4的溶度积常数(Ksp)为1×10-8
B. 含有大量CrO 的溶液中一定不存在Ag+
的溶液中一定不存在Ag+
C. a点表示Ag2CrO4的不饱和溶液,蒸发可以使溶液由a点变到b点
D. 0.02mol·L-1的AgNO3溶液与0.02mol·L-1的Na2CrO4溶液等体积混合会生成沉淀
⑸若常温下Ksp[Cr(OH)3]=10-32,要使c(Cr3+)降至10-5mol·L-1,溶液的pH应调至_______。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表为元素周期表的一部分,表中列出了11种元素在周期表中的位置,按要求完成下列各小题。
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | ⑥ | | ⑦ | ⑨ | |
| 3 | ① | ③ | ⑤ | | | | ⑧ | ⑩ |
| 4 | ② | ④ | | | | | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用化学用语回答下列问题:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ① | | | | | | | |
| 二 | | | | ② | | ③ | ④ | |
| 三 | ⑤ | | ⑥ | ⑦ | ⑧ | | ⑨ | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D 同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的气体在水中呈碱性,C和E形成的化合物在水中呈中性。回答下列问题:
(1)五种元素中,原子半径最大的是 ,非金属性最强的是 (填元素符号);
(2)由A和B、D、E所形成的共价型化合物中,热稳定性最差的是 (用化学式表示);
(3)A和E形成的化合物与A和B形成的化合物反应,产物的化学式为 ,其中存在的化学键类型为 ;
(4)D最高价氧化物的水化物的化学式为 ;
(5)单质E的原子结构示意图为 ;D在不充足的E中燃烧,生成的主要产物的化学式为 ;
(6)单质E与水反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
短周期主族元素A、B、C、D、E、F的原子序数依次增大,它们的原
子核外电子层数之和为13。B的化合物种类繁多,数目庞大;C、D是空气中含量最多的两种元素,D、E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期半径最小的元素。试回答以下问题:
(1)写出D与E以1∶1的原子个数比形成的化合物的电子式: 。F的原子结构示意图为: 。
(2)B、D形成的化合物BD2中存在的化学键为 键(填“离子”或“共价”,下同)。A、C、F三种元素形成的化合物CA4F为 化合物。
(3)化合物甲、乙由A、B、D、E中的三种或四种组成,且甲、乙的水溶液均呈碱性。则甲、乙反应的离子方程式为: 。
(4)A、C、D、E的原子半径由大到小的顺序是 (用元素符号表示)。
(5)元素B和F的非金属性强弱,B的非金属性 于F(填“强”或“弱”),并用化学方程式证明上述结论 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有A、B、C、D四种元素,A元素形成的—2价阴离子比氦原子的核外电子数多8个,B元素与A元素可组成一种化合物E,为淡黄色固体,该固体遇到空气能生成A的单质;C为原子核内有12个中子的金属元素,当2.4gC与足量热水反应时,在标准状况下放出气体2.24L,C形成正二价阳离子;D元素原子的M层上有7个电子。
(1)写出B、C两种元素的元素名称:B ,C ,指出D在周期表中的位置 。
(2)D的气态氢化物与H2S、HF的稳定性由强到弱为 (用化学式表示)。
(3)写出淡黄色固体E的电子式 ,其中含有的化学键为 。
(4)钾元素与B元素位于同一主族,钾元素与A元素可形成K2A、K2A2、KA2等多种化合物,其中K2A2和KA2和CO2均可发生反应(反应与淡黄色固体E和CO2的反应类似),写出KA2与CO2发生反应的化学方程式 。K2A2、KA2在医院、矿井、潜水、高空飞行中常用作供氧剂,为了维持气压稳定可以使用过氧化钾和超氧化钾的混合物使吸收的CO2与生成的O2体积相同(同温同压),则它
们的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1 mol E单质与足量酸作用,在标准状况下能产生33.6 L H2;E的阳离子与A的阴离子核外电子层结构完全相同。
回答下列问题: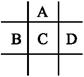
(1)A与E形成的化合物的化学式是 。
(2)B的最高价氧化物化学式为 ,C的元素名称为 ,D的单质与水反应的方程式为 ____________________________
(3)向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量,观察到的现象是
_____________________________________________________
有关反应的离子方程式为___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
常温下由三种短周期元素形成的气体单质X、Y、Z,并有下列转化关系(反应条件已略去):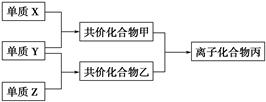
已知:X分子中含共价键最多;甲分子中含10个电子,乙分子含有18个电子。
(1)写出单质X的结构式是__________________________________;
(2)化合物甲的电子式是____________________________________;
(3)化合物丙中存在的作用力是______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com