
【题目】2018年北京市公交行业迈入氢能源时代。“制氢”“储氢”“用氢”等一直都是能源研究的热点。工业上制取H2有多种方法.如:
①C(s)+H2O(g)=CO(g)+H2(g) △H1=+131.5kJ·mol-1
②CH4(g)+H2O(g)=CO(g)+3H2(g) △H2=+206.2kJ·mol-1
③CH4(g)+CO2(g)=2CO(g)+2H2(g) △H3=+247.4kJ·mol-1
④2H2O(g)=2H2(g)+O2(g) △H4=+483.6kJ·mol-1
(1)CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为:____________________ .
(2)氢气燃料电池能大幅度提高能量的转化率。相同条件下,其能量密度(能量密度之比等于单位质量的可燃物转移电子数之比)是甲醇燃料电池的_______倍(计算结果保留两位有效数字)。
(3)科学家研发的“全氢电池"的工作原理如图所示,该电池工作一段时间后,右池溶液的导电 能力几乎不变。下列有关该电 池的说法正确的是 _____(填字母代号)。

a.电池的总反应是2H2 +O2 = 2H2O
b.左边电极上的电势高于右边电极上的电势
c.负极的电极反应是H2 - 2e- + 2OH- = 2H2O
d.装置中所用的是阴离子交换膜
e.产生能源的源泉是酸和碱的中和能
(4)LiFePO4电池稳定性高、安全、对环境友好,该电池的总反应式是Li1-xFePO4+LixC6![]() LiFePO4+C6,其放电时的工作原理如图所示。则:充电时,电极a的电极名称为_______________ ; 放电时电极b的电极反应式为______________________________ .
LiFePO4+C6,其放电时的工作原理如图所示。则:充电时,电极a的电极名称为_______________ ; 放电时电极b的电极反应式为______________________________ .

【答案】CH4(g)+H2O(g)=CO2(g)和H2(g)△H=+165.0 kJ·mol-1 3.67 ce 阴极 Li1xFePO4+xLi++xe=LiFePO4
【解析】
(1)已知②CH4(g)+H2O(g)=CO(g)+3H2(g) △H2=+206.2kJ·mol-1、③CH4(g)+CO2(g)=2CO(g)+2H2(g) △H3=+247.4kJ·mol-1;由盖斯定律,②×2-③得CH4(g)+H2O(g)=CO2(g)和H2(g)△H=+165.0 kJ·mol-1;
答案为:CH4(g)+H2O(g)=CO2(g)和H2(g)△H=+165.0 kJ·mol-1
(2)根据题意,氢气燃料电池的反应为4H2+O2=2H2O,可得8g氢气转移8个电子,氢气的能量密度为1,甲醇燃料电池反应式为2CH4O + 3O2 = 2CO2 + 4H2O,可得44g甲醇转移12个电子,甲醇的能量密度为![]() ,氢气的能量密度:甲醇的能量密度=1:
,氢气的能量密度:甲醇的能量密度=1:![]() =3.67
=3.67
答案为:3.67。
(3) 根据电子的流向,电池的左边为负极,右边为正极,
a. 负极电极反应是H22e+2OH═2H2O,正极电极反应是2e+2H+═H2,电池的总反应无氧气参加,故a错误;
b.电流从高电势流向低电势,电子的流向与电流相反,电子有低电势流向高电势,根据图示可得,电池左端电势小于右端电势,故b错误;
c. 左边吸附层M为负极,发生了氧化反应,电极反应是H2 - 2e- + 2OH- = 2H2O,故c正确;
d.由装置原理图所示,右池中氢离子得电子变为氢气,阳离子减少,由于右池溶液的导电能力几乎不变,需要补充阳离子,所以左池中的阳离子需要通过离子交换膜来补充右池,故为阳离子交换膜,故d错误;
e.根据电池的工作原理,左边吸附层M上氢气失电子与氢氧根结合生成水,发生了氧化反应为负极,电极反应是H2-2e-+2OH-═2H2O,右边吸附层N为正极,发生了还原反应,电极反应是2e-+2H+═H2,结合原电池中阳离子移向正极,阴离子移向负极,电子由负极经过导线进入正极,电池总反应为OH-+ H+= H2O,故e 正确;
答案为:ce;
(4)原电池中阳离子向正极移动,锂离子向电极b移动,则电极b为正极,电极a为负极;充电时b电极为阳极,阴极a极上C6得电子产生LixC6,电极反应式为C6+xLi++xe=LixC6;
放电时,正极b极上Li1xFePO4得电子产生LiFePO4,电极反应式为Li1xFePO4+xLi++xe=LiFePO4,
故答案为:阴极;Li1xFePO4+xLi++xe=LiFePO4。


科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是
2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是

A. ①中溶液橙色加深,③中溶液变黄
B. ②中Cr2O72-被C2H5OH还原
C. 对比②和④可知K2Cr2O7酸性溶液氧化性强
D. 若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科学家利用二氧化饰(CeO2)在太阳能作用下将H2O、CO2转变为H2、 CO,其过程如下所示:
mCeO2![]() (m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+x H2O+xCO2![]() mCeO2+xH2+xCO2
mCeO2+xH2+xCO2
下列说法不正确的是
A.该过程中CeO2是H2O、CO2转变为H2、CO反应的催化剂
B.利用CeO2作催化剂-既可使该转变过程速率提高。亦可减小能量的消 耗,并可提高反应物转化率
C.mmol CeO2参加反应,气体物质的量增加x mol
D.以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH - - 2e = CO32- +2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制硫酸中的一步重要反应是SO2在400-500℃和常压下的催化氧化: 2SO2 + O2![]() 2SO3, 这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述相关说法中错误的是
2SO3, 这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述相关说法中错误的是
A.反应温度选择400-500℃是该反应催化剂的催化活性、反应速率、反应限度等角度综合考虑的结果
B.因为在常压下该反应的速率和SO2的转化率已经很高了,所以选择常压条件主要是从生产成本角度考虑
C.为提高SO2的转化率,应适当提高O2的浓度
D.使用催化剂是为了加快反应速率,提高SO3产率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氧磷((POCl3)可用于制备增塑剂,常温下为无色透明液体,易挥发,易水解。一中化学兴趣小组探究制备POCl3所需的装置如下图所示:

反应原理:PCl3+Cl2+H2O![]() POCl3+2HCl(PC13常温下为液态,易挥发)。
POCl3+2HCl(PC13常温下为液态,易挥发)。
(1)仪器3的名称是 _________,仪器2中装入的物质为______,仪器I的作用是_____.
(2)请选择上述必要装置并组装,用小写字母连接:________________________。
(3)开始通入氯气。同时慢慢滴加水,控制氯气和水的质量比在3.94左右,理由是:________________________.
(4)上述装置有一处不足,请指岀该不足:__________________________.
(5)上述反应剩余PCl3可以继续通入Cl2,再和P4O10反应,也可以产生的POC13 .。 写出该反应的化学方程式:__________________________________ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气燃烧生成液态水的热化学方程式是2H2(g)+O2(g)===2H2O(1) ΔH=-572 kJ·mol-1。请回答下列问题:
(1)生成物能量总和________(填“大于”“小于”或“等于”)反应物能量总和。
(2)若2 mol氢气燃烧生成水蒸气,则放出的热量________(填“大于”“小于”或“等于”)572 kJ。
(3)H2的标准燃烧热ΔH=________。
(4)反应2H2+O2![]() 2H2O的能量变化如图所示。已知拆开1 mol H2、1 molO2和1 mol H—O中的化学键分别需要消耗436 kJ、496 kJ和463 kJ的能量。则反应过程(Ⅱ)________(填“吸收”或“放出”)________kJ。
2H2O的能量变化如图所示。已知拆开1 mol H2、1 molO2和1 mol H—O中的化学键分别需要消耗436 kJ、496 kJ和463 kJ的能量。则反应过程(Ⅱ)________(填“吸收”或“放出”)________kJ。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向10 mL 0.1 mol/L醋酸溶液中加水稀释后,下列说法正确的是( )
A. 溶液中离子的数目减小
B. 再加入CH3COONa固体能促进醋酸的电离
C. 醋酸的电离程度增大,c(H+)亦增大
D. 溶液中c(CH3COO-)/c(CH3COOH)c(OH-)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有14.4 g CO和CO2的混合气体,在标准状况下所占的体积约为8.96 L。回答下列问题:
(1)该混合气体的平均摩尔质量:_________________________。
(2)混合气体中碳原子的个数:_________________________
(用NA表示阿伏加德罗常数的值)。
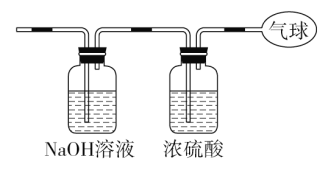
(3)将混合气体依次通过如图装置,最后收集在气球中。
①气球中收集到的气体摩尔质量:_______________________;
②标况下气球中收集到的气体的体积为___________________;
③气球中收集到的气体的电子总数为_____________________
(用NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒氧化还原液流电池是一种新型绿色的二次电池。其工作原理如图所示。下列叙述正确的是

A.电子由Y极流出,经质子交换膜到X极
B.放电过程中,电解质溶液pH降低
C.Y极反应式为V2+-e-=V3+
D.每转移1 mol,电子理论上有2 mol H+由交换膜右侧向左侧迁移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com