
ЁОЬтФПЁПЯжга14.4 g COКЭCO2ЕФЛьКЯЦјЬхЃЌдкБъзМзДПіЯТЫљеМЕФЬхЛ§дМЮЊ8.96 LЁЃЛиД№ЯТСаЮЪЬтЃК
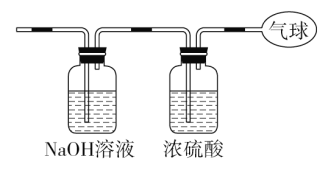
(1)ИУЛьКЯЦјЬхЕФЦНОљФІЖћжЪСПЃК_________________________ЁЃ
(2)ЛьКЯЦјЬхжаЬМдзгЕФИіЪ§ЃК_________________________
(гУNAБэЪОАЂЗќМгЕТТоГЃЪ§ЕФжЕ)ЁЃ
(3)НЋЛьКЯЦјЬхвРДЮЭЈЙ§ШчЭМзАжУЃЌзюКѓЪеМЏдкЦјЧђжаЁЃ
ЂйЦјЧђжаЪеМЏЕНЕФЦјЬхФІЖћжЪСПЃК_______________________ЃЛ
ЂкБъПіЯТЦјЧђжаЪеМЏЕНЕФЦјЬхЕФЬхЛ§ЮЊ___________________ЃЛ
ЂлЦјЧђжаЪеМЏЕНЕФЦјЬхЕФЕчзгзмЪ§ЮЊ_____________________
(гУNAБэЪОАЂЗќМгЕТТоГЃЪ§ЕФжЕ)ЁЃ
ЁОД№АИЁП36 gЁЄmolЃ1 0.4NA 28 gЁЄmolЃ1 4.48 L 2.8NA
ЁОНтЮіЁП
(1)ЛьКЯЦјЬхЕФЬхЛ§ЮЊ8.96 LЃЌдђЦфЮяжЪЕФСПЮЊnЃН![]() =
=![]() ЃН0.4 molЃЌЛьКЯЦјЬхЕФЦНОљФІЖћжЪСПЮЊ
ЃН0.4 molЃЌЛьКЯЦјЬхЕФЦНОљФІЖћжЪСПЮЊ![]() ЃН36 gЁЄmolЃ1ЃЛ
ЃН36 gЁЄmolЃ1ЃЛ
(2)ЩшЛьКЯЦјЬхжа COЕФЮяжЪЕФСПЮЊx molЃЌCO2ЕФЮяжЪЕФСПЮЊy molЃЌдђИљОнЛьКЯЮяЕФжЪСПЮЊ14.4 gПЩЕУЃК28xЃЋ44yЃН14.4ЃЛЂйЃЛИљОнЦјЬхЕФЮяжЪЕФСПЮЊ0.4 molЃЌЫљЕУxЃЋyЃН0.4ЂкЃЛНтЂйЂкЕУЃКxЃН0.2 molЃЌyЃН0.2 molЃЛгЩгкCOКЭCO2жаОљКЌ1ИіЬМдзгЃЌЙЪ0.2 mol COКЭ0.2 mol CO2жаЙВКЌ0.4 mol CдзгМД0.4NAИіЃЛ
(3)НЋЛьКЯЦјЬхвРДЮЭЈЙ§ШчЭМзАжУЃЌдђCO2ЛсБЛNaOHШмвКЮќЪеЃЌЪЃгрCOЃЌБЛХЈСђЫсИЩдяКѓЃЌдђдкЦјЧђжаЪеМЏЕНЕФЪЧИЩдяДПОЛЕФCOЦјЬхЃЛ
ЂйЦјЧђжаЪеМЏЕНЕФЦјЬхЮЊCOЃЌЖјвЛжжЮяжЪЕФФІЖћжЪСПдкЪ§жЕЩЯЕШгкИУЮяжЪЕФЯрЖдЗжзгжЪСПЃЌЙЪЪеМЏЕНЕФЦјЬхЕФФІЖћжЪСПЮЊ28 gЁЄmolЃ1ЃЛ
ЂкЦјЧђжаЕФЦјЬхЮЊCOЃЌЦфЬхЛ§VЃНnVmЃН0.2 molЁС22.4 LЁЄmolЃ1ЃН4.48 LЃЛ
Ђл1ИіCOКЌга14ИіЕчзгЃЌгЩ(2)ЧѓГіЕФCOЕФЮяжЪЕФСПЮЊ0.2 molЃЌдђЕчзгЕФЮяжЪЕФСПЮЊ0.2 molЁС14ЃН2.8 molЃЌЕчзгзмЪ§ЮЊ2.8NAИіЁЃ


 УћаЃПЮЬУЯЕСаД№АИ
УћаЃПЮЬУЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТЭМЪЧдЊЫижмЦкБэЕФвЛВПЗжЃЌAЁЂBЁЂCЁЂDЁЂEЁЂXЪЧжмЦкБэИјГідЊЫизщГЩЕФГЃМћЕЅжЪЛђЛЏКЯЮяЁЃ
Ђй | |||||||||||||||||
Ђм | Ђн | Ђо | |||||||||||||||
Ђк | Ђл | Ђп | |||||||||||||||
Fe | As | ||||||||||||||||
IЁЂдЊЫижмЦкБэЪЧШЫУЧбаОПЮяжЪаджЪЕФживЊЙЄОпЁЃYгЩЂкЂоЂпШ§жждЊЫизщГЩЃЌЫќЕФЫЎШмвКЪЧЩњЛюжаГЃМћЕФЯћЖОМСЁЃAsПЩгыYЕФЫЎШмвКЗДгІЃЌВњЮягаAsЕФзюИпМлКЌбѕЫсЃЌИУЗДгІЕФЛЏбЇЗНГЬЪНЮЊ_______ЃЌЕБЯћКФ1molЛЙдМСЪБЃЌзЊвЦЕФЕчзгИіЪ§ЮЊ_______ЁЃ
ЂђЁЂAЁЂBЁЂCЁЂDЁЂEЁЂXДцдкШчЯТЭМзЊЛЏЙиЯЕЁВВПЗжЩњГЩЮяКЭЗДгІЬѕМўТдШЅЁГЁЃ

ЃЈ1ЃЉМйЩшEЮЊбѕЛЏЮяЃЌФЧУДAгыЫЎЗДгІЕФЛЏбЇЗНГЬЪНЮЊ_______ЁЃ
ЂйЕБXЪЧМюадбЮШмвКЃЌCЗжзгжага22ИіЕчзгЪБЃЌФЧУДCЕФЕчзгЪНЮЊ_______ЁЃ
ЂкБэЪО
ЂлЕБXЮЊН№ЪєЕЅжЪЪБЃЌФЧУДXгыBЕФЯЁШмвКЗДгІЩњГЩCЕФРызгЗДгІЗНГЬЪНЮЊ_______ЁЃ
ЃЈ2ЃЉМйЩшEЮЊЕЅжЪЦјЬхЃЌDЮЊАзЩЋГСЕэЃЌBКЌгаЕФЛЏбЇМќРраЭЮЊ_______ЃЌCгыXЗДгІЕФРызгЗНГЬЪНЮЊ_______ЁЃ
ЃЈ3ЃЉЂйКЭЂнаЮГЩЕФЛЏКЯЮяЪЧвЛжжПЩШМадвКЬхЃЌЦфШМЩеВњЮяжЎвЛЪЧДѓЦјжаЕФвЊНєГЩЗжЃЌ1.6ПЫИУЮяжЪдкбѕЦјжаЭъШЋШМЩеЗХГіШШСП31.2kJЃЌаДГіШШЛЏбЇЗНГЬЪН_______ЁЃ
ЃЈ4ЃЉЗЯгЁЫЂЕчТЗАхЩЯКЌгаЭЃЌвдЭљЕФЛиЪеЗНЗЈЪЧНЋЦфзЦЩеЪЙЭзЊЛЏЮЊбѕЛЏЭЃЌдйгУСђЫсШмНтЁЃЯжИФгУЂйКЭЂозщГЩЕФЛЏКЯЮяКЭЯЁСђЫсНўХнЗЯгЁЫЂЕчТЗАхМШДяЕНЩЯЪіФПЕФЃЌгжБЃЛЄСЫЛЗОГЃЌЪдаДГіЗДгІЕФРызгЗНГЬЪН_______ЁЃ
ЃЈ5ЃЉдЊЫиЂкЕФЕЅжЪдквЛЖЈЬѕМўЯТЃЌФмгыЂйЕФЕЅжЪЛЏКЯЩњГЩвЛжжЛЏКЯЮяЃЌШлЕуЮЊ800ЁцЁЃИУЛЏКЯЮяФмгыЫЎЗДгІЗХЧтЦјЃЌМйЩшНЋ1molИУЛЏКЯЮяКЭ1molЂлаЮГЩЕФЕЅжЪЛьКЯМгШызуСПЕФЫЎЃЌГфЗжЗДгІКѓЩњГЩЦјЬхЕФЬхЛ§ЪЧЃЈБъзМзДПіЯТЃЉ_______ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП2018ФъББОЉЪаЙЋНЛаавЕТѕШыЧтФмдДЪБДњЁЃЁАжЦЧтЁБЁАДЂЧтЁБЁАгУЧтЁБЕШвЛжБЖМЪЧФмдДбаОПЕФШШЕуЁЃЙЄвЕЩЯжЦШЁH2гаЖржжЗНЗЈ.ШчЃК
ЂйC(s)ЃЋH2O(g)=CO(g)ЃЋH2(g) ЁїH1=ЃЋ131.5kJЁЄmolЃ1
ЂкCH4(g)ЃЋH2O(g)=CO(g)ЃЋ3H2(g) ЁїH2=ЃЋ206.2kJЁЄmolЃ1
ЂлCH4(g)ЃЋCO2(g)=2CO(g)ЃЋ2H2(g) ЁїH3=ЃЋ247.4kJЁЄmolЃ1
Ђм2H2O(g)=2H2(g)ЃЋO2(g) ЁїH4=ЃЋ483.6kJЁЄmolЃ1
ЃЈ1ЃЉCH4ЃЈgЃЉгыH2OЃЈgЃЉЗДгІЩњГЩCO2ЃЈgЃЉКЭH2ЃЈgЃЉЕФШШЛЏбЇЗНГЬЪНЮЊ:____________________ .
ЃЈ2ЃЉЧтЦјШМСЯЕчГиФмДѓЗљЖШЬсИпФмСПЕФзЊЛЏТЪЁЃЯрЭЌЬѕМўЯТЃЌЦфФмСПУмЖШЃЈФмСПУмЖШжЎБШЕШгкЕЅЮЛжЪСПЕФПЩШМЮязЊвЦЕчзгЪ§жЎБШЃЉЪЧМзДМШМСЯЕчГиЕФ_______БЖЃЈМЦЫуНсЙћБЃСєСНЮЛгааЇЪ§зжЃЉЁЃ
ЃЈ3ЃЉПЦбЇМвбаЗЂЕФЁАШЋЧтЕчГи"ЕФЙЄзїдРэШчЭМЫљЪОЃЌИУЕчГиЙЄзївЛЖЮЪБМфКѓЃЌгвГиШмвКЕФЕМЕч ФмСІМИКѕВЛБфЁЃЯТСагаЙиИУЕч ГиЕФЫЕЗЈе§ШЗЕФЪЧ _____ЃЈЬюзжФИДњКХЃЉЁЃ

a.ЕчГиЕФзмЗДгІЪЧ2H2 +O2 = 2H2O
b.зѓБпЕчМЋЩЯЕФЕчЪЦИпгкгвБпЕчМЋЩЯЕФЕчЪЦ
c.ИКМЋЕФЕчМЋЗДгІЪЧH2 - 2e- + 2OH- = 2H2O
d.зАжУжаЫљгУЕФЪЧвѕРызгНЛЛЛФЄ
e.ВњЩњФмдДЕФдДШЊЪЧЫсКЭМюЕФжаКЭФм
ЃЈ4ЃЉLiFePO4ЕчГиЮШЖЈадИпЁЂАВШЋЁЂЖдЛЗОГгбКУЃЌИУЕчГиЕФзмЗДгІЪНЪЧLi1-xFePO4ЃЋLixC6![]() LiFePO4ЃЋC6ЃЌЦфЗХЕчЪБЕФЙЄзїдРэШчЭМЫљЪОЁЃдђ:ГфЕчЪБЃЌЕчМЋaЕФЕчМЋУћГЦЮЊ_______________ ; ЗХЕчЪБЕчМЋbЕФЕчМЋЗДгІЪНЮЊ______________________________ .
LiFePO4ЃЋC6ЃЌЦфЗХЕчЪБЕФЙЄзїдРэШчЭМЫљЪОЁЃдђ:ГфЕчЪБЃЌЕчМЋaЕФЕчМЋУћГЦЮЊ_______________ ; ЗХЕчЪБЕчМЋbЕФЕчМЋЗДгІЪНЮЊ______________________________ .

ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПКЌMgCl2ЁЂAlCl3ОљЮЊnmolЕФЛьКЯШмвКЃЌЯђЦфжаЕЮNaOHШмвКжСЙ§СПЁЃМгШыNaOHЕФЮяжЪЕФСПгыЩњГЩГСЕэЕФЮяжЪЕФСПЕФЙиЯЕе§ШЗЕФЪЧЃЈРызгЃЈЛђЮяжЪЃЉГСЕэpHМћБэЃЉ
Рызг | Mg2+ | Al3+ | ЮяжЪ | Al(OH)3 |
ПЊЪМГСЕэЪБЕФpH | 8.93 | 3.56 | ПЊЪМШмНтЪБЕФpH | 8.04 |
ЭъШЋГСЕэЪБЕФpH | 10.92 | 4.89 | ЭъШЋШмНтЪБЕФpH | 12.04 |
A. 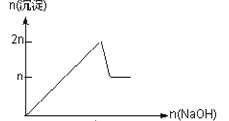
B. 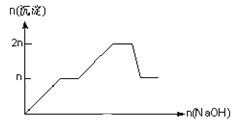
C. 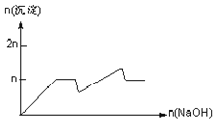
D. 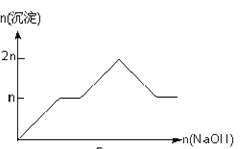
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЩшNAЮЊАЂЗќМгЕТТоГЃЪ§жЕЁЃЯТСагаЙиа№Ъіе§ШЗЕФЪЧЃЈ ЃЉ
A.25ЁцЃЌ1 LpH=13ЕФNaOHШмвКжаКЌгаOH-ЕФЪ§ФПЮЊ0.1NA
B.БъзМзДПіЯТЃЌ4.6 g NO2КЭN2O4ЛьКЯЮяжаКЌбѕдзгЪ§ЮЊ0.3NA
C.БъзМзДПіЯТЃЌ6.72 L Cl2гыЫЎГфЗжЗДгІЃЌзЊвЦЕчзгЪ§ЮЊ0.3NA
D.0.1 mol/L NaHCO3ШмвКжаЃЌHCO3-ЁЂH2CO3КЭCO32-змЪ§ЮЊ0.1NA
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊ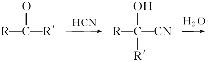
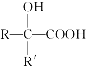 ЃЌВњЮяЗжзгБШдЛЏКЯЮяЗжзгЖрвЛИіЬМдзгЃЌдіГЄСЫЬМСДЁЃЗжЮіШчЭМБфЛЏЃЌВЂЛиД№гаЙиЮЪЬтЃК
ЃЌВњЮяЗжзгБШдЛЏКЯЮяЗжзгЖрвЛИіЬМдзгЃЌдіГЄСЫЬМСДЁЃЗжЮіШчЭМБфЛЏЃЌВЂЛиД№гаЙиЮЪЬтЃК
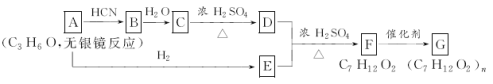
(1)аДГігаЙиЮяжЪЕФНсЙЙМђЪНЃКAЃК____________ЃЛCЃК________________ЁЃ
(2)жИГіЗДгІРраЭЃКCЁњDЃК___________ЃЛFЁњGЃК________________ЁЃ
(3)аДГіЯТСаЗДгІЕФЛЏбЇЗНГЬЪНЃКDЃЋEЁњFЃК_________________ЃЛ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТБэЮЊдЊЫижмЦкБэЕФвЛВПЗжЃЌaЁЂbЁЂcЁЮЊВПЗждЊЫиЁЃЛиД№ЯТСаЮЪЬтЃК
a | |||||||||||||||||
b | c | d | e | ||||||||||||||
f | g | ||||||||||||||||
h | |||||||||||||||||
(1)ЧыЛГіЩЯЪідЊЫиhЕФдзгНсЙЙЪОвтЭМ_______ЃЛдЊЫиhЮЛгкдЊЫижмЦкБэЕФЕк_____ЧјЁЃ
(2)eЁЂgСНжждЊЫиЕФЦјЬЌЧтЛЏЮяжаИќЮШЖЈЕФЪЧ_______ЃЈаДЛЏбЇЪНЃЉЃЛ
(3)b2a2ЗжзгЕФЕчзгЪНЪЧ________ ЃЌИУЗжзгжаДцдкЕФІвМќгыІаМќЕФИіЪ§БШЮЊ_______ЁЃ
(4)cЁЂdСНжждЊЫижаЕквЛЕчРыФмНЯДѓЕФЪЧ_________ЃЈаДдЊЫиЗћКХЃЉЁЃ
(5)fКЭgСНжждЊЫиаЮГЩЕФЛЏКЯЮяЪЧ______ЃЈЬюЁАРызгЛЏКЯЮяЁБЁАЙВМлЛЏКЯЮяЁБЃЉЁЃa2dЗжзгЪЧ_________ЗжзгЃЈЬюМЋадЗжзгЛђепЗЧМЋадЗжзгЃЉЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПжиИѕЫсМиЃЈK2Cr2O7ЃЉдкЦЄИяЁЂЛ№ВёЁЂгЁШОЛЏбЇЁЂЕчЖЦЕШЗНУцгІгУЙуЗКЁЃЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉОЦМнзэМнЮЃКІЩчЛсАВШЋЃЌдчЦкВтЖЈЪЧЗёвћОЦЕФЗНЗЈЪЧжиИѕЫсМиЗЈЃКШмвКгЩГШКьЩЋБфЮЊТЬЩЋЃЈCr3+ЃЉдђБэУївбОвћОЦЁЃаДГіжиИѕЫсМиЗЈМьбщвћОЦЕФРызгЗНГЬЪНЃК___________________________ЁЃ
ЃЈ2ЃЉгУИѕЬњПѓЃЈFeOCr2O3ЃЌКЌAl2O3дгжЪЃЉЮЊдСЯжЦБИжиИѕЫсМиЕФЙЄвеЃК
вбжЊЃКi. 2CrO42Љ+2H+ ![]() Cr2O72Љ+H2OЃЛ
Cr2O72Љ+H2OЃЛ
iiЃЎГЃЮТЃЌKsp[AlЃЈOHЃЉ3]ЃН1.3ЁС10Љ33ЃЛ
iiiЃЎгаЙиЮяжЪЕФШмНтЖШЧњЯпШчЭМЃК
ЂйЩЯЪіЙЄвеСїГЬЭМжаЕФВйзїIЕФжївЊЗДгІЮЊЃК2FeOCr2O3+4Na2CO3+7NaNO3![]() 4Na2CrO4+Fe2O3+4CO2Ёќ+7NaNO2ЃЌСэЭтвЛИіЗДгІЕФЛЏбЇЗНГЬЪНЪЧ__________ЁЃ
4Na2CrO4+Fe2O3+4CO2Ёќ+7NaNO2ЃЌСэЭтвЛИіЗДгІЕФЛЏбЇЗНГЬЪНЪЧ__________ЁЃ
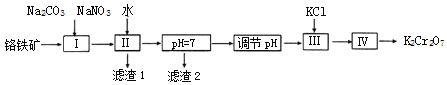
ЂкТЫдќ2ЕФГЩЗжЪЧ_____ЃЈаДЛЏбЇЪНЃЉЃЌГЃЮТЃЌТЫвКжаЃЌcЃЈAl3+ЃЉЃН_____molLЉ1
ЂлЙЄвеСїГЬЭМжаЃЌВйзїЁАЕїНкpHЁБЕФзїгУЪЧ_________________________________ЁЃ
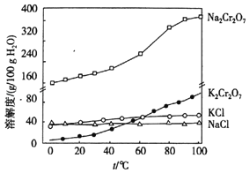
ЂмВйзїЂѓЃЌМгШыKClЕФФПЕФЪЧ________________________________________ЃЛЪЕбщЪвжаЃЌВйзїIVгУЕНЕФВЃСЇвЧЦїгаОЦОЋЕЦЁЂЩеБЁЂ___________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвдБНЮЊдСЯПЩвдКЯГЩгаЙиВњЦЗЃЌЦфСїГЬШчЭМЃК
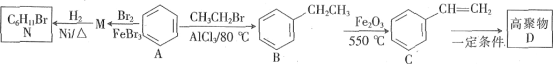
ЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉBЕФУћГЦЪЧ____ЁЃ
ЃЈ2ЃЉ1ИіCЗжзгзюЖрга___ИідзгЙВЦНУцЁЃ
ЃЈ3ЃЉAЁњMЕФЗДгІРраЭЪЧ___ЃЛCжаЙйФмЭХУћГЦЪЧ___ЁЃ
ЃЈ4ЃЉаДГіMЁњNЕФЛЏбЇЗНГЬЪНЃК____ЁЃ
ЃЈ5ЃЉNЕФвЛТШДњЮяга____жжЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com