
【题目】已知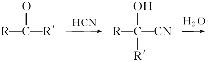
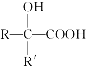 ,产物分子比原化合物分子多一个碳原子,增长了碳链。分析如图变化,并回答有关问题:
,产物分子比原化合物分子多一个碳原子,增长了碳链。分析如图变化,并回答有关问题:
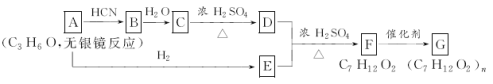
(1)写出有关物质的结构简式:A:____________;C:________________。
(2)指出反应类型:C→D:___________;F→G:________________。
(3)写出下列反应的化学方程式:D+E→F:_________________;
【答案】CH3COCH3 (CH3)2C(OH)COOH 消去反应 加聚反应 CH2=C(CH3)COOH+ CH3CH(OH)CH3![]() CH2=C(CH3)COOCH(CH3)2+H2O
CH2=C(CH3)COOCH(CH3)2+H2O
【解析】
A的分子式为C3H6O,且无银镜反应,所以A为CH3COCH3,A与HCN发生信息中的反应生成B为(CH3)2C(OH)CN,B水解生成C为(CH3)2C(OH)COOH ,C在浓硫酸作用下发生消去反应得D为CH2=C(CH3)COOH,A与氢气加成得E为CH3CH(OH)CH3,D与E发生酯化反应生成F为CH2=C(CH3)COOCH(CH3)2,F发生加聚反应得G为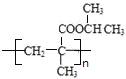 。
。
(1)根据上面分析可以知道,A为CH3COCH3,C为(CH3)2C(OH)COOH ,因此,本题正确答案是:CH3COCH3;(CH3)2C(OH)COOH。
(2)根据上面的分析可以知道,C→D为消去反应,F→G加聚反应,因此答案是:消去反应;加聚反应;
(3)D为CH2=C(CH3)COOH,E为CH3CHOHCH3,在浓硫酸作用下发生酯化反应,D+E→F的化学方程式为:CH2=C(CH3)COOH+ CH3CH(OH)CH3![]() CH2=C(CH3)COOCH(CH3)2+H2O;答案:CH2=C(CH3)COOH+ CH3CH(OH)CH3
CH2=C(CH3)COOCH(CH3)2+H2O;答案:CH2=C(CH3)COOH+ CH3CH(OH)CH3![]() CH2=C(CH3)COOCH(CH3)2+H2O。
CH2=C(CH3)COOCH(CH3)2+H2O。


科目:高中化学 来源: 题型:
【题目】深埋在潮湿土壤中的铁管道,在硫酸盐还原菌(一种厌氧微生物)的作用下,能被硫酸根离子腐蚀,其电化学腐蚀原理如图所示。下列与此原理有关的说法错误的是
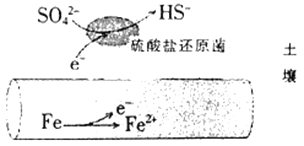
A.负极反应为SO42-+5H2O+8e-=HS-+9OH-
B.输送暖气的管道不易发牛此类腐蚀
C.这种情况下,Fe腐蚀的最终产物为FeO或Fe(OH)2
D.管道上刷富锌油漆可以延缓管道的腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气燃烧生成液态水的热化学方程式是2H2(g)+O2(g)===2H2O(1) ΔH=-572 kJ·mol-1。请回答下列问题:
(1)生成物能量总和________(填“大于”“小于”或“等于”)反应物能量总和。
(2)若2 mol氢气燃烧生成水蒸气,则放出的热量________(填“大于”“小于”或“等于”)572 kJ。
(3)H2的标准燃烧热ΔH=________。
(4)反应2H2+O2![]() 2H2O的能量变化如图所示。已知拆开1 mol H2、1 molO2和1 mol H—O中的化学键分别需要消耗436 kJ、496 kJ和463 kJ的能量。则反应过程(Ⅱ)________(填“吸收”或“放出”)________kJ。
2H2O的能量变化如图所示。已知拆开1 mol H2、1 molO2和1 mol H—O中的化学键分别需要消耗436 kJ、496 kJ和463 kJ的能量。则反应过程(Ⅱ)________(填“吸收”或“放出”)________kJ。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,在20.0mL0.10mol·L-1氯水中滴入0.10mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。己知0.10mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是

A. 该滴定过程应该选择酚酞作为指示剂
B. M点对应的盐酸体积为20.0mL
C. M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D. N点处的溶液中pH<12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有14.4 g CO和CO2的混合气体,在标准状况下所占的体积约为8.96 L。回答下列问题:
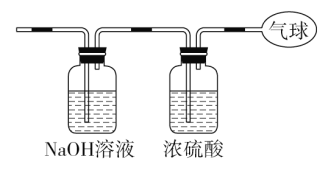
(1)该混合气体的平均摩尔质量:_________________________。
(2)混合气体中碳原子的个数:_________________________
(用NA表示阿伏加德罗常数的值)。
(3)将混合气体依次通过如图装置,最后收集在气球中。
①气球中收集到的气体摩尔质量:_______________________;
②标况下气球中收集到的气体的体积为___________________;
③气球中收集到的气体的电子总数为_____________________
(用NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于价电子构型为3s23p4的粒子描述正确的是( )
A. 它的元素符号为O
B. 它的核外电子排布式为1s22s22p63s23p4
C. 它可与H2生成固态化合物
D. 其基态电子排布图为: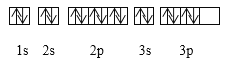
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.室温下浓度均为0.1 mol/L的盐酸和氨水混合呈中性时,消耗盐酸的体积大于氨水
B.室温下向0.1 mol/L氨水中加入等浓度等体积的盐酸,溶液导电能力增强
C.室温下pH相等的CH3COOH溶液和盐酸中,c(OH-)相等
D.室温下pH=1的CH3COOH溶液和pH=13的NaOH溶液中,c(CH3COO-)=c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从巴旦杏中提取有香味的有机物R,结构简式如图所示。下列有关R的说法错误的是
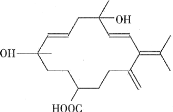
A.R既能与碳酸氢钠溶液反应,又能与钠粒反应
B.R能发生酯化、加成、氧化反应
C.R的羟基能在铜、加热条件下与O2反应生成醛基
D.R的分子式为C21H32O4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、Co、Ni均为第Ⅷ族元素,它们的化合物在生产、生活中有着广泛的应用。
(1)基态Co原子的价电子排布式为_______,Co2+核外3d能级上有_____对成对电子。
(2)Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co3+的配位数是________。1 mol配离子中所含σ键的数目为________,配位体N3-中心原子的杂化类型为________。
(3)Co2+在水溶液中以[Co(H2O)6]2+存在。向含Co2+的溶液中加入过量氨水可生成更稳定的[Co(NH3)6]2+,其原因是_________________________________________________。
(4)某蓝色晶体晶体结构如图,Fe2+、Fe3+分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个CN-,K+位于立方体的体心上。据此可知该晶体的化学式为________,立方体中Fe2+间连接起来形成的空间构型是________。K+空缺率(体心中没有K+的占总体心的百分比)为_____________。
(5)NiO的晶胞结构如图甲所示,其中原子坐标参数A为(0,0,0),B为(1,1,0),则C原子坐标参数为________。
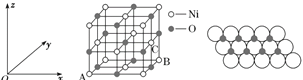
图甲 图乙
(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图乙),已知O2-的半径为a pm,每平方米面积上分散的该晶体的质量为________g(用含a、NA的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com