
【题目】下图是元素周期表的一部分,A、B、C、D、E、X是周期表给出元素组成的常见单质或化合物。
① | |||||||||||||||||
④ | ⑤ | ⑥ | |||||||||||||||
② | ③ | ⑦ | |||||||||||||||
Fe | As | ||||||||||||||||
I、元素周期表是人们研究物质性质的重要工具。Y由②⑥⑦三种元素组成,它的水溶液是生活中常见的消毒剂。As可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为_______,当消耗1mol还原剂时,转移的电子个数为_______。
Ⅱ、A、B、C、D、E、X存在如下图转化关系〔部分生成物和反应条件略去〕。

(1)假设E为氧化物,那么A与水反应的化学方程式为_______。
①当X是碱性盐溶液,C分子中有22个电子时,那么C的电子式为_______。
②表示
③当X为金属单质时,那么X与B的稀溶液反应生成C的离子反应方程式为_______。
(2)假设E为单质气体,D为白色沉淀,B含有的化学键类型为_______,C与X反应的离子方程式为_______。
(3)①和⑤形成的化合物是一种可燃性液体,其燃烧产物之一是大气中的要紧成分,1.6克该物质在氧气中完全燃烧放出热量31.2kJ,写出热化学方程式_______。
(4)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用①和⑥组成的化合物和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式_______。
(5)元素②的单质在一定条件下,能与①的单质化合生成一种化合物,熔点为800℃。该化合物能与水反应放氢气,假设将1mol该化合物和1mol③形成的单质混合加入足量的水,充分反应后生成气体的体积是(标准状况下)_______。
【答案】NaClO+2As+3H2O=2H3AsO4+5NaCl 5NA 3NO2+H2O=2HNO3+NO ![]() CO32-+H2O
CO32-+H2O![]() HCO3-+OH- Fe+4H++NO3-=Fe3++NO↑+2H2O 离子键和极性共价键 Al3++3AlO2-+6H2O=4Al(OH)3↓ N2H4(l)+O2(g)=N2(g)+2H2O(l)ΔH=-624kJ·mol-1 Cu+2H++H2O2=Cu2++2H2O 56L
HCO3-+OH- Fe+4H++NO3-=Fe3++NO↑+2H2O 离子键和极性共价键 Al3++3AlO2-+6H2O=4Al(OH)3↓ N2H4(l)+O2(g)=N2(g)+2H2O(l)ΔH=-624kJ·mol-1 Cu+2H++H2O2=Cu2++2H2O 56L
【解析】
根据元素在周期表中的位置分析元素的种类;根据氧化还原反应原理书写反应方程式;根据物质性质及转化关系分析物质种类并书写反应方程式及电子式;根据燃烧热计算反应热并书写热化学方程式;根据反应方程式及物质的量与体积的关系进行相关计算。
由元素在周期表中位置,可知①为H②为Na③为Al④为C.⑤为N⑥为O⑦为Cl;.
Ⅰ、Y由②⑥⑦三种元素组成,它的水溶液是生活中常见的消毒剂,则Y为NaClO,As可与Y的水溶液反应,物有As的最高价含氧酸,即生成H3AsO4,根据化合价升降相等可知还有NaCl生成,反应方程式为:5NaClO+2As+3H2O=2H3AsO4+5NaCl,As元素化合价由0升高为+5,转移电子数为5,故消耗1mol还原剂时,转移的电子个数为5NA,故答案为:5NaClO+2As+3H2O=2H3AsO4+5NaCl;5NA;
Ⅱ、能和水反应的物质有金属氧化物、非金属氧化物、金属和非金属。
(1)若E为氧化物,常温下与A与水反应生成E,则为二氧化氮与水反应生成硝酸与NO,故A为NO2,B为HNO3,E为NO,反应方程式为:3NO2+H2O=2HNO3+NO;
①当X是碱性盐溶液,C分子中有22个电子时,则X为碳酸盐,C为CO2,D为碳酸氢盐,则:C的电子式为![]() ,表示X呈碱性的离子方程式为CO32-+H2O
,表示X呈碱性的离子方程式为CO32-+H2O![]() HCO3-+OH-;
HCO3-+OH-;
②当X为金属单质时,由转化关系可知,X为变价金属,故X为Fe,C为硝酸铁,D为硝酸亚铁,则X与B的稀溶液反应生成C的离子反应方程式为:Fe+4H++NO3-=Fe3++NO↑+2H2O;
(2)若E为单质气体,D为白色沉淀,则A为Na或过氧化钠,E为氢气或氧气,B为NaOH,X为氯化铝,C为偏铝酸钠,D为氢氧化铝,B(NaOH)含有的化学键类型为:离子键、共价键,C与X反应的离子方程式为 Al3++3AlO2-+6H2O=4Al(OH)3↓;
(3)①和⑤形成的化合物是一种可燃性液体,其燃烧产物之一是大气中的主要成分,则该化合物为N2H4,1molN2H4燃烧放出的热量为31.2kJ×1mol×32g/mol1.6g=624kJ,该反应热化学方程式为:N2H4(l)+O2(g)=N2(g)+2H2O(l) ΔH=-624kJ·mol-1;
(4)双氧水有强氧化性,酸性条件下,双氧水能氧化铜生成铜离子同时生成水,反应离子方程式为:Cu+2H++H2O2=Cu2++2H2O;
(5)氢气和钠反应生成氢化钠,氢化钠和水反应生成氢氧化钠和氢气,氢氧化钠和铝反应生成氢气,反应方程式为:NaH+H2O=NaOH+H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,1mol氢化钠和水反应生成1mol氢氧化钠和1mol氢气,1mol氢氧化钠和铝反应生成1.5mol氢气,故标况下生成氢气体积为(1mol+1.5mol)×22.4L/mol=56L。


科目:高中化学 来源: 题型:
【题目】25℃时,向浓度均为0.1mol·L-1、体积均为100mL的两种一元酸HX、HY溶液中分别加入NaOH固体,溶液中![]() 随n(NaOH)的变化如图所示。下列说法正确的是
随n(NaOH)的变化如图所示。下列说法正确的是

A.HX为弱酸,HY为强酸
B.水的电离程度:b>c>d
C.C点对应的溶液中:c(HY)>c(Y-)
D.若将c点与d点的溶液全部混合,溶液中离子浓度大小:c(Na+)>c(X-)>c(Y-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是
2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是

A. ①中溶液橙色加深,③中溶液变黄
B. ②中Cr2O72-被C2H5OH还原
C. 对比②和④可知K2Cr2O7酸性溶液氧化性强
D. 若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)是一种高效清洁的火箭燃料。0.25molN2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量。则下列热化学方程中正确的是( )
A.![]() N2H4(g)+
N2H4(g)+![]() O2(g)=
O2(g)=![]() N2(g)+H2O(l) △H=+267kJmol-1
N2(g)+H2O(l) △H=+267kJmol-1
B.N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-133.5kJmol-1
C.N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=+534kJmol-1
D.N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品并精制流程:

依照上述流程回答以下问题:
(1)混合①中发生反应的化学方程式为_______。
(2)操作Ⅱ和操作Ⅲ的名称分别是_______、_______。操作Ⅲ一般适用于分离____________混合物。〔选填编号〕
a、固体和液体b、固体和固体c、互不相溶的液体d、互溶的液体
(3)混合②中加入Na2SO3的目的是_______。
(4)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸〔工业氢溴酸〕带有淡淡的黄色。因此甲乙两同学设计了简单实验加以探究:甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,那么用于证明该假设所用的试剂的名称为_______。乙同学假设工业氢溴酸呈淡黄色是因为________,其用于证明该假设所用的试剂的化学式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】深埋在潮湿土壤中的铁管道,在硫酸盐还原菌(一种厌氧微生物)的作用下,能被硫酸根离子腐蚀,其电化学腐蚀原理如图所示。下列与此原理有关的说法错误的是
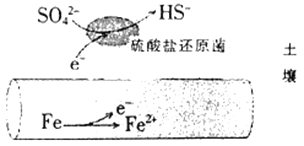
A.负极反应为SO42-+5H2O+8e-=HS-+9OH-
B.输送暖气的管道不易发牛此类腐蚀
C.这种情况下,Fe腐蚀的最终产物为FeO或Fe(OH)2
D.管道上刷富锌油漆可以延缓管道的腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科学家利用二氧化饰(CeO2)在太阳能作用下将H2O、CO2转变为H2、 CO,其过程如下所示:
mCeO2![]() (m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+x H2O+xCO2![]() mCeO2+xH2+xCO2
mCeO2+xH2+xCO2
下列说法不正确的是
A.该过程中CeO2是H2O、CO2转变为H2、CO反应的催化剂
B.利用CeO2作催化剂-既可使该转变过程速率提高。亦可减小能量的消 耗,并可提高反应物转化率
C.mmol CeO2参加反应,气体物质的量增加x mol
D.以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH - - 2e = CO32- +2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制硫酸中的一步重要反应是SO2在400-500℃和常压下的催化氧化: 2SO2 + O2![]() 2SO3, 这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述相关说法中错误的是
2SO3, 这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述相关说法中错误的是
A.反应温度选择400-500℃是该反应催化剂的催化活性、反应速率、反应限度等角度综合考虑的结果
B.因为在常压下该反应的速率和SO2的转化率已经很高了,所以选择常压条件主要是从生产成本角度考虑
C.为提高SO2的转化率,应适当提高O2的浓度
D.使用催化剂是为了加快反应速率,提高SO3产率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有14.4 g CO和CO2的混合气体,在标准状况下所占的体积约为8.96 L。回答下列问题:
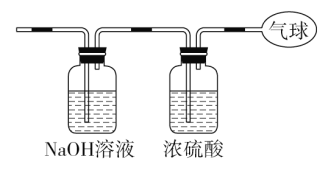
(1)该混合气体的平均摩尔质量:_________________________。
(2)混合气体中碳原子的个数:_________________________
(用NA表示阿伏加德罗常数的值)。
(3)将混合气体依次通过如图装置,最后收集在气球中。
①气球中收集到的气体摩尔质量:_______________________;
②标况下气球中收集到的气体的体积为___________________;
③气球中收集到的气体的电子总数为_____________________
(用NA表示阿伏加德罗常数的值)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com