
����Ŀ�����и�������ʾ��ͼһ�µ���
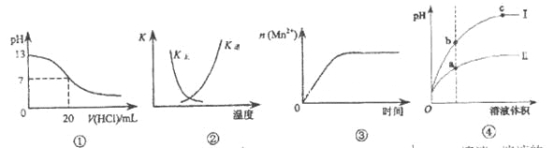
A.ͼ�ٱ�ʾ25��ʱ����0.1 mol![]() ����ζ�20 mL 0.1 mol
����ζ�20 mL 0.1 mol![]() NaOH��Һ����Һ��pH�����������ı仯
NaOH��Һ����Һ��pH�����������ı仯
B.ͼ�������߱�ʾ��Ӧ��![]() �����淴Ӧ��ƽ�ⳣ��K���¶ȵı仯
�����淴Ӧ��ƽ�ⳣ��K���¶ȵı仯
C.ͼ�۱�ʾ10 mL 0.0l mol![]() KMnO4������Һ�������0.1 mol
KMnO4������Һ�������0.1 mol![]() H2C2O4��Һ���ʱ��n(Mn2��)��ʱ��ı仯
H2C2O4��Һ���ʱ��n(Mn2��)��ʱ��ı仯
D.IΪ��ǿ��ϡ��ʱpH�仯�����ߣ���b����Һ�ĵ����Ա�c����Һ�ĵ�������
���𰸡�B
��������
A��0.1molL-1NaOH��Һ��pHΪ13����0.1molL-1����ζ�ǡ���к�ʱpHΪ7����Ũ����ͬ���������ͬ��������к��ڽӽ��յ�ʱ��pH�ᷢ��ͻ�䣬���ߵ�б�ʻ�ܴ���
B����ӦΪ���ȷ�Ӧ���������¶ȣ�ƽ�������ƶ���ƽ�������K��������K�����С����ȷ��
C���䷴Ӧ�Ƿ��ȷ�Ӧ������Ӧ���ɵ�Mn2+�Ը÷�Ӧ�д����ã��ʷ�Ӧ����Խ��Խ�죬ͼ��������б�ʱ�����������ȫ��Ӧ�����ʲ��ڱ仯������
D��ǿ��ϡ��ʱpH�仯�ϴ�����I�ǽ�ǿ�ᣬb���pHС��c�㣬˵��b��������Ũ�ȴ���c�㣬����b�����Һ�ĵ����Ա�c����Һ�ĵ�����ǿ������
��ѡB��


 ͬ����ϰǿ����չϵ�д�
ͬ����ϰǿ����չϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����X������Ԫ����ɣ���������õ��ȵ����ܣ����ȵ�ת��������й�����Ӧ��ǰ����Ϊ�о�������ɺ����ʣ���ȡ12.30g������X��������ʵ�飺

�Ը����������ݻش��������⣺
(1)X�Ļ�ѧʽΪ_____________��
(2)��ɫ��ҺB��ͨ�����CO2������ɫ���������ӷ���ʽΪ______________��
(3)��ɫ��ҺF��ͨ����SO2����������ɫ�������ó�������Ԫ����������Ϊ35.7%�������ӷ���ʽΪ____________��
(4)��ɫ����C���յĹ��������D���·�Ӧ�����ɻ�����X���仯ѧ����ʽΪ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ�����SO2�����Ƿ�ﵽ�ŷű��ķ�Ӧԭ����SO2 +H2O2 + BaCl2 ===BaSO4��+ 2HCl��NA��ʾ����٤������������˵����ȷ���ǣ� ��
A. 0.1 mol BaCl2����������������Ϊ0.1NA
B. 25 ��ʱ��pH =1��HCl��Һ�к���H+����ĿΪ0.1NA
C. 17 g H2O2�к��зǼ��Լ���ĿΪ0.5NA
D. ����2.33 g BaSO4����ʱ��ת�Ƶ�����ĿΪ0.01NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʮ����(12CaO��7Al2O3)�����͵ij������Ϻͷ�����ϣ��ð���ʯ(��Ҫ��CaCO3��MgCO3)�ͷ�AlƬ�Ʊ�����ʮ���ƵĹ������£�
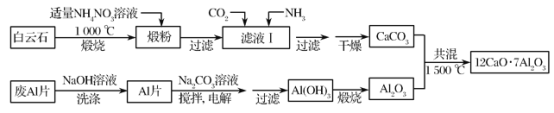
��1���ѷ���Ҫ��MgO��________��������NH4NO3��Һ��ȡ�ѷۺ�þ�����X�����ܣ�����Һ����c(Mg2��)С��5��10��6mol��L��1������ҺpH����________[Mg(OH)2��Ksp��5��10��12]���ù����в�����(NH4)2SO4����NH4NO3��ԭ����______________��
��2����Һ���е���������________(�������ʳɷֵ�Ӱ��)������Һ���н�ͨ��CO2��������________���Ӷ�����CaCO3���ʽ��͡�
��3����NaOH��Һ�ɳ�ȥ��AlƬ���������Ĥ����Ӧ�����ӷ���ʽΪ_________��
��4������Ʊ�Al(OH)3ʱ���缫�ֱ�ΪAlƬ��ʯī������ܷ�Ӧ����ʽ________��
��5��һ�ֿɳ��������������أ���ŵ�ʱAlCl4����Al2Cl7������������Al�缫���ת�����������Ӳ�����缫��Ӧ���ŵ�ʱ����Al�ĵ缫��ӦʽΪ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������SO2��NO2������˵���������
A. ������NaOH��Һ��Ӧ����������B. ����ʹʯ����Һ���
C. ��������⻯ѧ�����Ĵ�����Ⱦ��D. ��ҵ�����ᡢ����ʱҪ�õ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ǹ�Ч���Ͷ�������������֪��ClO2��һ�ֻ���ɫ������ˮ�����壬����ǿ�����ԣ��ش��������⣺
(1)ClO2���Ʊ�������̽��(��ͼ��ʾ)��

������a������Ϊ________��װ��B��������________��
��װ��C�����Ʊ�ClO2��ͬʱ������һ����ʽ�Σ��÷�Ӧ�Ļ�ѧ����ʽΪ_________��װ��D�е��м��ε�����Һ����������________________��
��װ��E��������β������Ӧ����NaClO2����÷�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ________������������___________��
(2)���Բⶨ����ClO2����
ʵ�鲽�����£�
a. ȡ��װ��D�������е���Һת��250mL����ƿ��������ˮϴ��Dƿ2~3�Σ�����ϴ��Һһ��ת�Ƶ�����ƿ�У���������ˮϡ�����̶ȡ�
b. ������ƿ��ȡ��25.00mL��Һ����ƿ�У���0.1000mol/L��������Ʊ���Һ�ζ���I2+2S2O32-=2I��+S4O62-����ָʾ����ʾ�յ�ʱ����ȥ24.00 mL�����������Һ��
�ٵζ����յ��������_____________��
�ڽ���װ��D�е�ClO2����Ϊ_______����C��ClO2�����۲�����ȣ��ⶨֵƫ�ͣ����ܵ�ԭ����__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ�״���½�1.92gͭ��Ͷ��һ����ŨHNO3�У�����ͭ�۵��ܽ⣬��Ӧ���ɵ�������ɫ��dz����ͭ����ȫ�ܽ���ռ�����NO2��NO��ɵĻ������1.12 L����Ӧ����HNO3�����ʵ���Ϊ
A. 0.08molB. 0.06molC. 0.11molD. ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������0.10 mol��L-1NaOH��Һ�ֱ�ζ�20.00mLŨ�Ⱦ�Ϊ0.10mol��L-1CH3COOH(Ka=1.75��10-5)��Һ��HCN��Ka=4.9��10-10����Һ���õζ���������ͼ������˵����ȷ����

A. ����I������II�ֱ��������CH3COOH��HCN
B. ��ٺ͵����ʾ��Һ�У� ![]()
C. ��ۺ͵����ʾ��Һ����ˮ�������c(H+)����>��
D. �ڵ�ں͢�֮�䣨�������˵㣩���ڹ�ϵ��c(Na+)��c(CH3COO-)��c(H+)��c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.1 mol��L��1 NaOH��Һ�ζ�40 mL 0.1 mol��L��1 H2SO3��Һ�����õζ�������ͼ��ʾ�����Ի��ʱ��Һ����ı仯������������������ǣ� ��
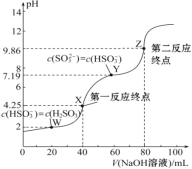
A. Ka2(H2SO3)��������Ϊ10��8
B. ���ζ�����һ��Ӧ�յ㣬���ü�����ָʾ��
C. ͼ��Z���Ӧ����Һ�У�c(Na��)>c(SO32��)>c(HSO3��)>c(OH��)
D. ͼ��Y���Ӧ����Һ�У�3c(SO32��)��c(Na��)��c(H��)��c(OH��)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com