
����Ŀ����1�����������������������ֳ�����������д�ڿհ״���
�ٰ�п������ϡ������ʱ��������ų��� ��
��ʢ��Ũ������ձ����ڷ���һ��ʱ����������ӡ� ��
���ò�����պŨ�������ֽ��ʱ��ֽ��ڡ� ��
�ܰ�ľ̿�����ȵ�Ũ������ʱ��������ų��� ��
���ڳ����¿�����������������ʢװ���Ũ���ᡣ ___ ��
��2��ʵ������ȡ�����Ļ�ѧ����ʽ: ��
��3��ͭ��ϡ���ᷴӦ�����ӷ���ʽ: ��
��4��ͭ��Ũ���ᷴӦ�Ļ�ѧ����ʽ: ��
��5������������Һ�������Һ���ȷ��������ӷ���ʽ: ��
���𰸡���1�������ԣ� ����ˮ���� ����ˮ���� ��ǿ�����ԣ���ǿ�����ԣ�
��2��Ca(OH)2��2NH4Cl![]() CaCl2+2NH3��+2H2O��
CaCl2+2NH3��+2H2O��
��3��3Cu��8H����2NO3��=3Cu2����2NO����4H2O��
��4��Cu+4HNO3(Ũ)=Cu(NO3)2+2NO2��+2H2O��
��5��NH4++ OH��![]() NH3��+H2O��
NH3��+H2O��
��������
�����������1����п�DZȽϻ��õĽ��������������е����û�����������������������ֳ����ͨ�ԣ���Ũ���������ˮ������ʢ��Ũ������ձ����ڷ���һ��ʱ��������������������տ����е�ˮ������������Ũ��������л����H��O����Ԫ����2:1ԭ�Ӹ�����ȥ��������ˮ���� ����ľ̿�����ȵ�Ũ������ʱ��Ũ������C���ʷ���������ԭ��Ӧ������CO2��SO2��H2O�����������ų����ڸ÷�Ӧ��Ũ�������ǿ�����ԣ����ڳ����¿�����������������ʢװ���Ũ��������������ᱻ��������һ�����ܵ������ﱡĤ����ֹ������һ�����������ڸ÷�Ӧ��Ũ�������ǿ�����ԣ���2��ʵ����������������ȷ�����Ӧ��ȡ��������ȡ�����Ļ�ѧ����ʽ��Ca(OH)2��2NH4Cl![]() CaCl2+ 2NH3��+2H2O����3��ͭ��ϡ����������Ӧ����������ͭ��NO��ˮ����Ӧ�����ӷ���ʽ��3Cu��8H����2NO3��=3Cu2����2NO����4H2O����4��ͭ��Ũ���ᷴӦ��������ͭ��NO2��ˮ����Ӧ�Ļ�ѧ����ʽ��Cu+4HNO3(Ũ)=Cu(NO3)2+2NO2��+2H2O����5������������Һ�������Һ���ȷ�������������ˮ����Ӧ�����ӷ���ʽ��NH4++ OH��
CaCl2+ 2NH3��+2H2O����3��ͭ��ϡ����������Ӧ����������ͭ��NO��ˮ����Ӧ�����ӷ���ʽ��3Cu��8H����2NO3��=3Cu2����2NO����4H2O����4��ͭ��Ũ���ᷴӦ��������ͭ��NO2��ˮ����Ӧ�Ļ�ѧ����ʽ��Cu+4HNO3(Ũ)=Cu(NO3)2+2NO2��+2H2O����5������������Һ�������Һ���ȷ�������������ˮ����Ӧ�����ӷ���ʽ��NH4++ OH��![]() NH3��+H2O��
NH3��+H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У������й����ε���( )
A��ˮ���� B����оƬ C����� D����ͨˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Դ�ͻ������������������ע���ȵ㻰�⡣��ش��������⣺
����Ŀǰ����̼����������Ϊ��ѧ���о�����Ҫ���⡣��������������һ���Ƚ������ⷽ�����䷴Ӧ����ʽΪCH4(g) +H2O (g) =CO (g) +3H2(g) ��
�Ķ���ͼ������÷�Ӧ�ķ�Ӧ����H=____________kJ��mol-1��
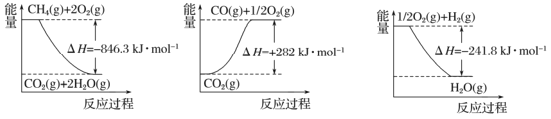
�����ռ�������CO2�ǻ����������ȵ���⡣
500��ʱ�����ݻ�Ϊ1L���ܱ������г���1 mol CO2��3 mol H2���������·�Ӧ��CO2(g) +3H2 (g) ![]() CH3OH (g) +H2O (g) ��H��0�����CO2��CH3OH��Ũ����ʱ��Ĺ�ϵ��ͼ��ʾ��
CH3OH (g) +H2O (g) ��H��0�����CO2��CH3OH��Ũ����ʱ��Ĺ�ϵ��ͼ��ʾ��
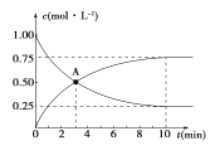
��1��0~10 min��v(H2)=_____________��
A�㺬����_____________��
�÷�Ӧƽ�ⳣ������ʽK=____________��
��2����Ӧ��500���ﵽƽ��ı䷴Ӧ�¶�ΪT��CH3OH��Ũ����ÿ����0��030 mol/L������5 min�ִﵽ��ƽ�⡣T____________(����>������<������=��)500�����ж�������___________________��
��3���¶�ΪTʱ����Ӧ�ﵽƽ�����Ӧ�������ݻ�����һ����ƽ����____________(����������������)��Ӧ�����ƶ����ж�������____________��
�����绯ѧ������SO2��Ŀǰ�о����ȵ㡣
����˫��ˮ����SO2������SO2��Ⱦ�����װ����ͼ��ʾ��
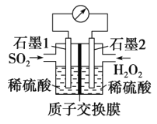
��1��ʯī1Ϊ___________(��������������������)��
�����ĵ缫��ӦʽΪ____________��
��2����11.2 L(��״��)SO2���뷴Ӧ����Ǩ��H+�����ʵ���Ϊ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��ֻ������÷�Һ©���������
A��ˮ�ͱ� B��ˮ���Ҵ� C����;ƾ� D��������Ҵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D����Ԫ�أ�ԭ��������������Aԭ�ӵ����������4�����ӣ�B�������Ӻ�C�������Ӿ�����ͬ�ĵ��Ӳ�ṹ����Ԫ�صĵ��ʷ�Ӧ������һ�ֵ���ɫ�Ĺ���E��D��L�����������K��M�������Ӳ��ϵĵ�����֮�͡�
��1��AΪ ��BΪ ��CΪ ��D ������д��Ӧ��Ԫ�����ƣ�
��2��д����C��D��Ԫ����ɵĻ�����ĵ���ʽ ��
��3��A�����������ĵ���ʽ ��C�����������ˮ����ĵ���ʽ , ����ɫ�Ĺ���E�ĵ���ʽ ��
��4��д��A��B�Ļ�������E��Ӧ�Ļ�ѧ����ʽ�� ��
��5��д��DԪ�ص�����������ˮ�����A�ĵ��ʷ�Ӧ�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Դ����ǰ��ʮ�ֹ�������ˮɹ���ܹ��õ����κ�±ˮ��±ˮ�к���MgCl2��KCl��MgSO4�����ʣ���ͼ�����ǵ��ܽ�����ߡ�������˵������ȷ����

A��t1��ʱ���������ʵı�����Һ�У�������������������MgCl2
B��t1��ʱ���ֱ���100gˮ���ܽ��˵�������MgCl2��KCl������Һ���ɴﵽ����
C��t2��ʱ��KCl��MgSO4�������ʵ��ܽ����ͬ
D����±ˮ���ȵ�t2�� ���ϣ������ľ�����ҪΪMgSO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڻ�ѧ��Ӧ��������˵����ȷ����
A. �кͷ�Ӧ�����ȷ�Ӧ B. ȼ�����ڷ��ȷ�Ӧ
C. ��ѧ�����ѷų����� D. ��Ӧ����������������������һ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˶�Ա����ɵ��ܡ�������Ŀʱ���á�þ�ۡ����֣�������Ч����ij�֡�þ�ۡ��п��ܺ���Mg��MgO��Mg(OH)2��MgCO3�е�һ�ֻ����ֹ��壬ʵ��С�����ɷ�չ����̽����
��֪��MgO+2HCl=MgCl2+H2O MgCO3+2HCl=MgCl2+H2O+CO2��
��1��̽����þ�ۡ����Ƿ���Mg��MgCO3
��ȡ������Ʒ����ͼ��ʾ����ʵ�顣�۲쵽a�Թ��������ݲ�����b�Թ��в���������������ʯ��ˮ����ǣ���֤����þ�ۡ���һ������______��

��Ϊ֤����þ�ۡ����Ƿ���Mg��С����ȼ�ŵ�ľ������ͼ��b�Թܿ��Ϸ���ľ��Ϩ�𡣵�ͬѧ��ָ������ʵ�鲻�ܴ��ʵ��Ŀ�ģ���Ҫ��ͼ�еij���ʯ��ˮ�滻��ŨNaOH��Һ��Ŀ����______________��С�������ĺ��ʵ�鷽���ظ�����ʵ�飬�۲쵽b�Թ�������������֤����þ�ۡ���______________��
��2��̽����þ�ۡ����Ƿ���MgO��Mg(OH)2
��ʵ����̡�
��.��MgO��Mg(OH)2��MgCO3���ֹ���ֱ�������ʵ�顣�ֱ�ȡ0.5g���ֹ����ĩ��ÿ��ȡ��������ͼ2��ʾ��

��μ�����ͬ��������������ϡ����ֱ����ĩǡ����ʧ�����±��м�¼���ĵ�ͬŨ��ϡ���������������������ͬһ�����²ⶨ���ұ�����С�����1λ��
MgO | Mg(OH)2 | MgCO3 | |
����ϡ�������� /mL | 10.4 | 7.2 | 5.0 |
Mg(OH)2�����ᷢ���кͷ�Ӧ�Ļ�ѧ����ʽΪ_____________��
��.ȡ��þ�ۡ���Ʒ0.5 g����������ϡ��������ĩǡ���ܽ⡣��ʱ����ϡ��������ԼΪ5.3 mL��
��ʵ����������ۡ�
��þ�ۡ���ֻ����MgCO3��������____________________________________��
��ʵ�鷴˼��
Ϊȷ����þ�ۡ��ľ���ɷ֣�ͬѧ����Ϊ����Ҫ��������ʵ�飺�ֱ�ȡ0.5 g��þ�ۡ���0.5 g_________����������ϡ���ᣬ�ⶨ���ɵ���������ֱ�Ϊ119mL��140mL���ɴ˿�֪��þ�ۡ��к���MgCO3����������Ϊ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ҹ�������н�ֹ����ʹ�ú�Ǧ���ͣ�����Ҫԭ����
A. �������ȼ��Ч�� B. �������ͳɱ�
C. ����Ǧ��Ⱦ���� D. Ǧ��Դ��ȱ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com