
ЎѕМвДїЎїФЪИЭ»эОЄ2ЙэµДГЬ±ХИЭЖчЦРЈ¬УР·ґУ¦mAЈЁgЈ©Ј«nBЈЁgЈ©![]() pCЈЁgЈ©Ј«qDЈЁgЈ©Ј¬ѕ№э5·ЦЦУґпµЅЖЅєвЈ¬ґЛК±Ј¬ёчОпЦКµД±д»ЇОЄAјхЙЩБЛa molЎ¤L-1Ј¬BµДЖЅѕщ·ґУ¦ЛЩ¶ИVBЈЅa/15molЎ¤L-1Ў¤min-1Ј¬CФцјУБЛ2a/3 molЎ¤L-1Ј¬ХвК±ИфФцјУПµНіС№ЗїЈ¬·ўПЦAУлCµД°Щ·Цє¬БїІ»±дЈ¬Фтm©Un©Up©UqОЄЈЁ Ј©
pCЈЁgЈ©Ј«qDЈЁgЈ©Ј¬ѕ№э5·ЦЦУґпµЅЖЅєвЈ¬ґЛК±Ј¬ёчОпЦКµД±д»ЇОЄAјхЙЩБЛa molЎ¤L-1Ј¬BµДЖЅѕщ·ґУ¦ЛЩ¶ИVBЈЅa/15molЎ¤L-1Ў¤min-1Ј¬CФцјУБЛ2a/3 molЎ¤L-1Ј¬ХвК±ИфФцјУПµНіС№ЗїЈ¬·ўПЦAУлCµД°Щ·Цє¬БїІ»±дЈ¬Фтm©Un©Up©UqОЄЈЁ Ј©
AЈ®3©U1©U2©U2 BЈ®1©U3©U2©U2
CЈ®1©U3©U2©U1 DЈ®1©U1©U1©U1
Ўѕґр°ёЎїA
ЎѕЅвОцЎї
КФМв·ЦОцЈє 5minДЪЈ¬VB=![]() mol/ЈЁLminЈ©Ј¬№КЎчcЈЁBЈ©=
mol/ЈЁLminЈ©Ј¬№КЎчcЈЁBЈ©=![]() mol/ЈЁLminЈ©ЎБ5min=
mol/ЈЁLminЈ©ЎБ5min=![]() mol/LЈ¬ЕЁ¶И±д»ЇБїЦ®±ИµИУЪ»ЇС§јЖБїКэЦ®±ИЈ¬№КmЈєnЈєp=a mol/LЈє
mol/LЈ¬ЕЁ¶И±д»ЇБїЦ®±ИµИУЪ»ЇС§јЖБїКэЦ®±ИЈ¬№КmЈєnЈєp=a mol/LЈє![]() mol/LЈє
mol/LЈє![]() mol/L=3Јє1Јє2Ј¬ФцјУПµНіС№ЗїЈ¬AУлCµД°Щ·Цє¬БїІ»±дЈ¬ЛµГчЖЅєвІ»ТЖ¶ЇЈ¬№К·ґУ¦З°єуЖшМеµДОпЦКµДБїІ»±дЈ¬јґm+n=p+qЈ¬№К3+1=2+qЈ¬№Кq=2Ј¬ЛщТФmЈєnЈєpЈєq=3Јє1Јє2Јє2Ј¬№КСЎAЎЈ
mol/L=3Јє1Јє2Ј¬ФцјУПµНіС№ЗїЈ¬AУлCµД°Щ·Цє¬БїІ»±дЈ¬ЛµГчЖЅєвІ»ТЖ¶ЇЈ¬№К·ґУ¦З°єуЖшМеµДОпЦКµДБїІ»±дЈ¬јґm+n=p+qЈ¬№К3+1=2+qЈ¬№Кq=2Ј¬ЛщТФmЈєnЈєpЈєq=3Јє1Јє2Јє2Ј¬№КСЎAЎЈ


 РВїО±кН¬ІЅСµБ·ПµБРґр°ё
РВїО±кН¬ІЅСµБ·ПµБРґр°ё Т»ПЯГыК¦їЪЛгУ¦УГМвМмМмБ·Т»±ѕИ«ПµБРґр°ё
Т»ПЯГыК¦їЪЛгУ¦УГМвМмМмБ·Т»±ѕИ«ПµБРґр°ё
| Дкј¶ | ёЯЦРїОіМ | Дкј¶ | іхЦРїОіМ |
| ёЯТ» | ёЯТ»Гв·СїОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СїОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СїОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СїОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СїОіМНЖјцЈЎ | іхИэ | іхИэГв·СїОіМНЖјцЈЎ |
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїПВБРКµСй»щ±ѕІЩЧчґнОуµДКЗ( )
A. µО¶Ё№ЬѕХфБуЛ®Пґѕ»єуЈ¬јґїЙЧўИл±кЧјТєЅшРРµО¶Ё
B. ІЈБ§µј№ЬХєЛ®єуЈ¬±ЯРэЧЄ±ЯПтПрЖ¤№ЬЦРІеИл
C. µО¶ЁУГЧ¶РОЖїѕХфБуЛ®Пґѕ»єуЈ¬І»РлУГ±кЧјТєИуПґ
D. УГІЈБ§°фХєИЎґэІвТєµОµЅpHКФЦЅЙПЈ¬И»єуёъ±кЧј±ИЙ«їЁПа¶ФХХЈ¬¶БіцpH
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїЗвСхИјБПµзіШКЗ·ыєПВМЙ«»ЇС§АнДоµДРВРН·ўµзЧ°ЦГЎЈЖ乤ЧчФАнИзНјЛщКѕЈ¬ёГµзіШµДµзј«±нГж¶ЖБЛТ»ІгПёРЎµДІ¬·ЫЈ¬ТСЦЄІ¬ОьёЅЖшМеµДДЬБ¦ЗїЈ¬ЗТРФЦКОИ¶ЁЎЈ

(1)ЗвСхИјБПµзіШДЬБїЧЄ»ЇµДЦчТЄРОКЅКЗ_______ЈЁМоЎ°µзДЬЧЄ»ЇОЄ»ЇС§ДЬЎ±»тЎ°»ЇС§ДЬЧЄ»ЇОЄµзДЬЎ±Ј©ЎЈ
(2)НЁИлH2µДµзј«ОЄ______ЈЁМоЎ°Хэј«Ў±»тЎ°ёєј«Ў±Ј©Ј¬ёГµзј«µДµзј«·ґУ¦КЅОЄ____________ЎЈ
(3)µзј«±нГж¶ЖІ¬·ЫµДФТтКЗ____________________ЎЈ
(4)ЛжЧЕµзіШІ»¶П·ЕµзЈ¬µзЅвЦКИЬТєµДјоРФ________ЈЁМоЎ°ФцЗїЎ±Ў°јхИхЎ±»тЎ°І»±дЎ±Ј©ЎЈ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎї№ММеAµД»ЇС§КЅОЄNH5Ј¬ЛьµДЛщУРФЧУµДЧоНвІг¶ј·ыєППаУ¦ПЎУРЖшМеµДЧоНвµзЧУІгЅб№№Ј¬ФтПВБРУР№ШЛµ·ЁІ»ХэИ·µДКЗЈЁ Ј©
A. 1 mol NH5ЦРє¬УР5 NAёцN©ЃHјьЈЁNA±нКѕ°ў·ьјУµВВЮіЈКэЈ©
B. NH5ЦРјИУР№ІјЫјьУЦУРАлЧУјь
C. NH5µДµзЧУКЅОЄ![]()
D. ЛьУлЛ®·ґУ¦µДАлЧУ·ЅіМКЅОЄNH4++H©Ѓ+H2O=NH3H2O+H2Ўь
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїПВБРАлЧУ·ЅіМКЅХэИ·µДКЗ(ЎЎЎЎ)
A. МјЛбЗвп§ИЬТєУлЙЩБїЗвСх»ЇДЖИЬТєЈєNH![]() Ј«HCO
Ј«HCO![]() Ј«2OHЈ===NH3Ў¤H2OЈ«CO
Ј«2OHЈ===NH3Ў¤H2OЈ«CO![]() Ј«H2O
Ј«H2O
B. ВИ»Їп§ИЬТєЦРјУИлЙЩБїПЎЗвСх»ЇДЖИЬТєЈєNH![]() Ј«OHЈ===NH3ЎьЈ«H2O
Ј«OHЈ===NH3ЎьЈ«H2O
C. °±Л®УлСОЛб·ґУ¦ЈєNH3Ў¤H2OЈ«HЈ«===NH![]() Ј«H2O
Ј«H2O
D. °±Л®ЦРНЁИл№эБї¶юСх»ЇМјЈє2NH3Ў¤H2OЈ«CO2===2NH![]() Ј«CO
Ј«CO![]() Ј«H2O
Ј«H2O
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїПВБРЅрКфµДТ±Б¶№эіМЦРЈ¬РијУИл»№ФјБµДКЗ(ЎЎЎЎ)
A. HgOЁDЎъHg B. Al2O3ЁDЎъAl
C. Ag2OЁDЎъAg D. CuSO4ЁDЎъCu
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎї°СµИОпЦКµДБїµДNa2SO4ЎўNaClЎўAgNO3»мєПОп·ЕИлЧгБїЛ®ЦРЈ¬ѕід·ЦЅБ°иєуЈ¬Ѕ«ЛщµГИЬТєУГКЇД«µзј«ЅшРРµзЅвЈ¬Сфј«ЙъіЙµДОпЦККЗ ( )
AЈ®H2 BЈ®Ag CЈ®Cl2 DЈ®O2
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїЖыіµЕЕ·ЕµДОІЖшОЄґуЖшОЫИѕФґЦ®Т»Ј¬ДїЗ°Ј¬їЙАыУГТФПВ»ЇС§ФАнЅвѕцОІЖшЈє2NOЈ«2CO![]() 2CO2Ј«N2ЎЈ
2CO2Ј«N2ЎЈ
ЈЁ1Ј©РґіцCO2µДЅб№№КЅ____________Ј¬N2µДµзЧУКЅ___________ЎЈ
ЈЁ2Ј©Т»¶ЁМхјюПВЈ¬ФЪИЭ»э№М¶ЁµДИЭЖчЦРЅшРРЙПКц·ґУ¦Ј¬COЕЁ¶ИУлК±јд№ШПµИзНјЛщКѕЈє
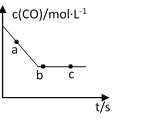
ўЩФт·ґУ¦ЛЩВК¦Ф(a)Ўў¦Ф(b)Ўў ¦Ф(c)µДґуРЎ№ШПµКЗ______________Ј»
ўЪПВБРїЙЛµГч·ґУ¦µЅґпНјЦРcµгµДКЗ__________Ј»
AЈ®NOЎўCOЎўCO2ЎўN2±нКѕµДЛЩВК±ИЦµ±ЈіЦ2©U2©U2©U1І»±д
BЈ®COµДЕЁ¶ИІ»ФЩёД±д
CЈ®·ґУ¦ПыєД2molNOµДН¬К±ПыєД1molN2
DЈ®ИЭЖчЦРµДЖшМеЦКБї»тОпЦКµДБї±ЈіЦІ»±д
ЈЁ3Ј©ОЄСРѕїИзєОМбёЯёГЧЄ»Ї№эіМ·ґУ¦ЛЩВКЈ¬ДіїОМвЧйЅшРРБЛТФПВКµСйМЅѕїЎЈ
ЎѕЧКБПІйФДЎї
AЈ®І»Н¬µДґЯ»ЇјБ¶ФН¬Т»·ґУ¦µДґЯ»ЇР§ВКІ»Н¬Ј»
BЈ®К№УГµИЦКБїПаН¬µДґЯ»ЇјБК±Ј¬ґЯ»ЇјБµД±И±нГж»э¶ФґЯ»ЇР§ВКУРУ°ПмЎЈ
ЎѕКµСйЙијЖЎїїОМвЧйОЄМЅѕїДіР©НвЅзМхјю¶ФЖыіµОІЖшЧЄ»Ї·ґУ¦ЛЩВКµДУ°Пм№жВЙЈ¬ЙијЖБЛТФПВ¶Ф±ИКµСйЎЈ
КµСй±аєЕ | КµСйДїµД | T/Ўж | NOіхКјЕЁ¶И mol/L | COіхКјЕЁ¶И mol/L | Н¬ЦЦґЯ»ЇјБµД±И±нГж»э m2/g | ґпЖЅєвК±ЛщУГµДК±јдmin |
ўс | ІОХХКµСй | 280 | 6.50ЎБ10-3 | 4.00ЎБ10-3 | 80 | t |
ўт | 280 | 6.50ЎБ10-3 | 4.00ЎБ10-3 | 120 | 0.5t | |
ўу | 360 | 6.50ЎБ10-3 | 4.00ЎБ10-3 | 80 | 0.2t |
ЎѕЅбВЫЎїўЩКµСй±аєЕўтµДКµСйДїµДОЄ_________________________ЎЈ
ўЪїОМвЦРМЅѕїНвЅзМхјю¶ФЖыіµОІЖшЧЄ»Ї·ґУ¦ЛЩВКµДУ°ПмµДБнТ»ТтЛШКЗ___________Ј¬ЗТ____________·ґУ¦ЛЩВКЅ«___________ЎЈЈЁМоЎ°ФцґуЎ±ЎўЎ°јхРЎЎ±ЎўЎ°ОЮУ°ПмЎ±Ј©ЎЈ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїXЎўYЎўZИэЦЦЦчЧеФЄЛШµДµҐЦКФЪіЈОВПВ¶јКЗіЈјыµДОЮЙ«ЖшМеЈ¬ФЪККµ±МхјюПВЈ¬ИэХЯЦ®јдїЙТФБЅБЅ·ўЙъ·ґУ¦ЙъіЙ·Ц±рКЗЛ«єЛЎўИэєЛєНЛДєЛµДјЧЎўТТЎў±ыИэЦЦ·ЦЧУЈ¬ЗТТТЎў±ы·ЦЧУЦРє¬УРXФЄЛШµДФЧУёцКэ±ИОЄ2ЎГ3ЎЈЗл»ШґрПВБРОКМвЈє
(1)ФЄЛШXµДГыіЖКЗ________Ј¬±ы·ЦЧУµДµзЧУКЅОЄ________ЎЈ
(2)ИфјЧУлYµҐЦКФЪіЈОВПВ»мєПѕНУРГчПФПЦПуЈ¬ФтјЧµД»ЇС§КЅОЄ________ЎЈ±ыФЪТ»¶ЁМхјюПВЧЄ»ЇОЄјЧєНТТµД·ґУ¦·ЅіМКЅОЄ___________________________ЎЈ
(3)»ЇєПОп¶Ўє¬XЎўYЎўZИэЦЦФЄЛШЈ¬¶ЎКЗТ»ЦЦіЈјыµДЗїЛбЈ¬Ѕ«¶ЎУл±ы°ґОпЦКµДБїЦ®±И1ЎГ1»мєПєуЛщµГОпЦКОмµДѕ§МеЅб№№ЦРє¬УРµД»ЇС§јьОЄ________(СЎМоРтєЕ)ЎЈ
aЈ®Ц»є¬№ІјЫјь bЈ®Ц»є¬АлЧУјь cЈ®јИє¬АлЧУјьЈ¬УЦє¬№ІјЫјь
Ійїґґр°ёєНЅвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБР±н - КФМвБР±н
єю±±КЎ»ҐБЄНшОҐ·ЁєНІ»БјРЕПўѕЩ±ЁЖЅМЁ | НшЙПУРє¦РЕПўѕЩ±ЁЧЁЗш | µзРЕХ©ЖѕЩ±ЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРє¦РЕПўѕЩ±ЁЧЁЗш | ЙжЖуЗЦИЁѕЩ±ЁЧЁЗш
ОҐ·ЁєНІ»БјРЕПўѕЩ±Ёµз»°Јє027-86699610 ѕЩ±ЁУКПдЈє58377363@163.com