
【题目】下列电离方程式的书写错误的是 ( )。
A.BaCl2=Ba2++Cl-B.Na2CO3=2Na++CO32-
C.MgCl2=Mg2++2Cl-D.Ba(OH)2=Ba2++2OH-
科目:高中化学 来源: 题型:
【题目】关于蛋白质的叙述,错误的是( )
A. 人体血浆中含有浆细胞分泌的蛋白质 B. DNA和蛋白质是染色体的组成成分
C. rRNA能参与蛋白质的生物合成 D. 核糖体上合成的蛋白质不能在细胞核发挥作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饮用水中的![]() 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中![]() 的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将
的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将![]() 还原为N2,其化学方程式为10Al+6NaNO3+4NaOH===10NaAlO2+3N2↑+2H2O。
还原为N2,其化学方程式为10Al+6NaNO3+4NaOH===10NaAlO2+3N2↑+2H2O。
请回答下列问题:
(1)上述反应中,________元素的化合价升高,则该元素的原子________(填“得到”或“失去”)电子;而________元素的化合价降低,则该元素的原子被________(填“氧化”或“还原”)。
(2)用“双线桥法”表示反应中电子转移的方向和数目:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列物质分类全部正确的是( )
①纯碱 ②食盐水 ③石灰水 ④NaOH ⑤液态氧 ⑥KClO3
A.碱--①④B.纯净物--③④C.盐--①⑥D.混合物--②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、环境、科技等密切相关。下列说法不正确的是
A. 天津市2018年启动实施生活垃圾分类,推进生活垃圾分类投放、分类收集、分类运输、分类处置,下图是崇仁里社区垃圾处理方法符合政府要求

B. 锅炉水垢中含有的硫酸钙,可先用碳酸钠溶液处理,后用酸除去
C. 聚乙炔用碘或钠等掺杂处理后可形成导电塑料,该导电塑料有固定的熔沸点
D. 具有吸水性的植物纤维加工后可以用作食品干燥剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生设计了一个“黑笔红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是( )
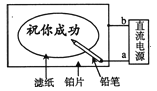
A. 铅笔芯作阳极,发生还原反应
B. 铂片端作阴极,发生氧化反应
C. 铅笔端附近有少量的氯气产生
D. 红字是H+放电,c(OH-)增大造成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用生活中或实验室中常用的物品,根据氧化还原反应知识和电化学知识,自己动手设计了一个原电池。请填写下列空白:
(1)实验原理:Fe+2H+===Fe2++H2↑
(2)实验用品:电极(________、________)、稀硫酸、________、________、耳机(或者电流表)(填写所缺的实验用品)。
(3)实验装置如图。

(4)原电池设计及注意的问题:
①按如图所示装置连接好实验仪器,注意观察(耳朵听)耳机是否有声音发出,如果没有,可将原电池的两个电极中的一极接触耳机插头上的一极(注意:接触的同时耳机的另一个极是连接在原电池的另一个电极上的),这时可以听见耳机发生“嚓嚓嚓……”的声音。其原因是在原电池中,由化学能转化为________,在耳机中又由________转化为声音这种能量;
②如果将装置中的耳机改为电流表,则铁钉应该接电流表的______极,电极反应式为____,发生了______反应;
③铜钉应该接电流表的__________极,电极反应式为____________________________,发生了________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的(Na+和SO42-)可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是( )
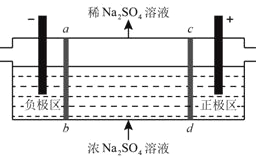
A. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
B. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液碱性增强
C. 阴极区溶液pH降低,阳极区溶液pH升高
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g) + CO(g)![]() CH3OH(g)
CH3OH(g)
(1)下表所列数据是该反应在不同温度下的化学平衡常数(K)
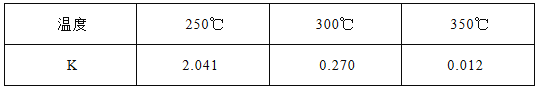
①该反应的熵变△S 0(填:“<,>,=”)。该反应在 (填:高温或低温)条件下能自发进行。
②要提高CO的转化率,可以采取的措施是_____________(填序号)。
a.升温
b.加入催化剂
c.增加CO的浓度
d.加入H2加压
e.加入惰性气体加压
f.分离出甲醇
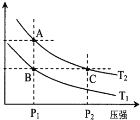
(2)如图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A__________C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A___________C,由状态B到状态A,可采用___________的方法(填“升温”或“降温”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com