
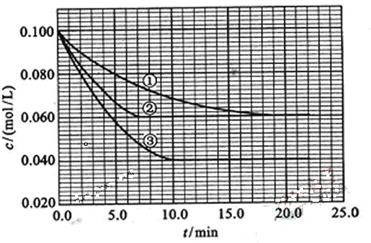


科目:高中化学 来源: 题型:
A、 |
B、 |
| C、CH3CH2CH2COO(CH2)3CH3 |
| D、CH2=CHCH2COO(CH2)3CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该溶液中溶质一定为NaHSO3与Na2SO3 | ||||
B、溶液中c(Na+)=c(S
| ||||
| C、溶液中离子浓度最大的是Na+ | ||||
| D、向该溶液中加入氯化钾固体,溶液依然呈中性,且有c(K+)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电离时能生成H+的化合物是酸 |
| B、水溶液显碱性的物质是碱 |
| C、电解质电离时产生的阴离子全部是OH-的化合物是碱 |
| D、能与碱发生反应生成水的化合物是酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学反应的限度决定于反应物的性质,与外界条件无关 |
| B、合成氨反应在一定条件下达到平衡后,N2、H2、NH3物质的量之比保持恒定 |
| C、增大反应物的用量一定会加快反应速率 |
| D、浓度、温度、压强、催化剂既是影响反应速率的因素又是影响反应限度的因素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
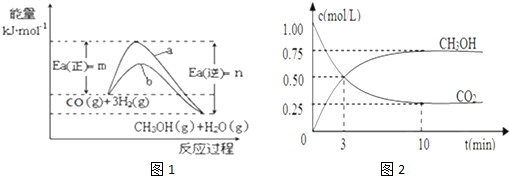
| n(CH3OH) |
| n(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com