
| A、电离时能生成H+的化合物是酸 |
| B、水溶液显碱性的物质是碱 |
| C、电解质电离时产生的阴离子全部是OH-的化合物是碱 |
| D、能与碱发生反应生成水的化合物是酸 |


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
| A、酶是具有催化作用的蛋白质 |
| B、酶具有选择性和专一性 |
| C、高温或重金属盐能降低酶的活性 |
| D、酶遇到浓硫酸显示黄色,叫做颜色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、2MgO
| ||||
B、MgCl2
| ||||
| C、Mg(OH)2+2HCl═MgCl2+2H2O | ||||
| D、Mg2++2OH-═Mg(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
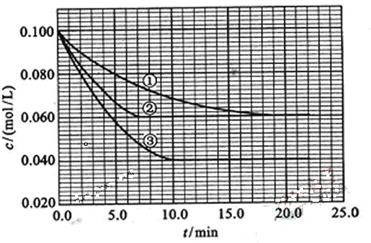
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子半径:Al3+<Mg2+<F- |
| B、酸性:H2SiO3<H3PO4<H2SO4<HClO4 |
| C、热稳定性:HI>HBr>HCl>HF |
| D、碱性:NaOH>Mg(OH)2>Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(SO3)=4 mol?L-1?min-1 |
| B、v(O2)=2 mol?L-1?min-1 |
| C、v(SO2)=5 mol?L-1?min-1 |
| D、v(SO2)=0.1 mol?L-1?S-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com