


科目:高中化学 来源: 题型:
| A、电离时能生成H+的化合物是酸 |
| B、水溶液显碱性的物质是碱 |
| C、电解质电离时产生的阴离子全部是OH-的化合物是碱 |
| D、能与碱发生反应生成水的化合物是酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
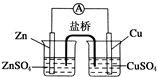 下列说法正确的是( )
下列说法正确的是( )| A、盐桥中的阴离子向硫酸铜溶液中迁移 |
| B、锌电极发生还原反应,铜电极发生氧化反应 |
| C、铜电极上发生的电极反应是2H++e-→H2↑ |
| D、电子从锌电极通过检流计流向铜电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若A2和B2的总能量之和大于生成的2AB的总能量,则反应放热 |
| B、若A2和B2的总能量之和小于生成的2AB的总能量,则反应放热 |
| C、若该反应为放热反应,则Q1+Q2>Q3 |
| D、若该反应为吸热反应,则Q1+Q2<Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaCl | MgCl2 | AlCl3 | SiCl4 | |
| 熔点(℃) | 801 | 714 | 190* | -68 |
| 沸点(℃) | 1465 | 1418 | 180 | 57 |
| A、AlCl3在加热时升华 |
| B、SiCl4晶体属于分子晶体 |
| C、1500℃时NaCl存在气态分子 |
| D、AlCl3晶体是典型的离子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、它们相差一个电子层 |
| B、它们都能与水反应 |
| C、钠原子、钠离子均为同一元素,因此是同种微粒 |
| D、灼烧时,它们的焰色反应都呈紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 编号 | 待测氢氧化钠溶液体积(mL) | 滴定开始读数(mL) | 滴定结束读数(mL) | 消耗盐酸体积(mL) |
| ① | 25.00 | 0.02 | 26.40 | |
| ② | 25.00 | 0.04 | 25.81 | |
| ③ | 25.00 | 0.03 | 25.78 | |
| ④ | 25.00 | 0.20 | 25.96 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com