
| NaCl | MgCl2 | AlCl3 | SiCl4 | |
| 熔点(℃) | 801 | 714 | 190* | -68 |
| 沸点(℃) | 1465 | 1418 | 180 | 57 |
| A、AlCl3在加热时升华 |
| B、SiCl4晶体属于分子晶体 |
| C、1500℃时NaCl存在气态分子 |
| D、AlCl3晶体是典型的离子晶体 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
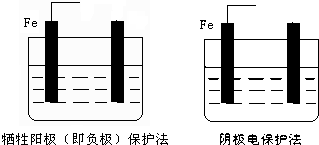
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| △ |
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| SO2 | O2 | SO2 | O2 | |||
| 1 | T1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | 4 | 2 | 0.4 | y | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应是放热还是吸热要由反应物和生成物所具有的总能量来决定 |
| B、需要加热才能发生的反应可能是吸热反应也可能是放热反应 |
| C、放热的反应在常温下一定很容易发生 |
| D、反应热可用量热计测量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A的最简单氢化物 | B的最简单氢化物 | M的最简单氢化物 | X的氧化物 | Y的最简单氢化物 | Z的最高价氧化物 |
| 含氢量最高的有机物 | 水溶液呈碱性 | 水溶液呈酸性 | 两性氧化物 | 分子呈正四面体构型 | 对应水化物为最强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com