
| ||
| △ |
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| SO2 | O2 | SO2 | O2 | |||
| 1 | T1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | 4 | 2 | 0.4 | y | 9 |
| ||
| 6min |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
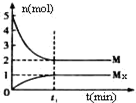 E是非金属性最强的元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下关系:xM(g)?Mx(g),反应物和生成物的物质的量随时间的变化关系如图.下列说法正确的是( )
E是非金属性最强的元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下关系:xM(g)?Mx(g),反应物和生成物的物质的量随时间的变化关系如图.下列说法正确的是( )| A、该反应的化学方程式是2HF?(HF)2 | ||
B、t1时刻,保持温度不变,再充入1molM,重新达到平衡时,
| ||
| C、平衡时混合气体的平均摩尔质量是33.3 | ||
| D、M的沸点比同主族下一周期元素的气态氢化物沸点低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
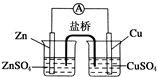 下列说法正确的是( )
下列说法正确的是( )| A、盐桥中的阴离子向硫酸铜溶液中迁移 |
| B、锌电极发生还原反应,铜电极发生氧化反应 |
| C、铜电极上发生的电极反应是2H++e-→H2↑ |
| D、电子从锌电极通过检流计流向铜电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若A2和B2的总能量之和大于生成的2AB的总能量,则反应放热 |
| B、若A2和B2的总能量之和小于生成的2AB的总能量,则反应放热 |
| C、若该反应为放热反应,则Q1+Q2>Q3 |
| D、若该反应为吸热反应,则Q1+Q2<Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaCl | MgCl2 | AlCl3 | SiCl4 | |
| 熔点(℃) | 801 | 714 | 190* | -68 |
| 沸点(℃) | 1465 | 1418 | 180 | 57 |
| A、AlCl3在加热时升华 |
| B、SiCl4晶体属于分子晶体 |
| C、1500℃时NaCl存在气态分子 |
| D、AlCl3晶体是典型的离子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、它们相差一个电子层 |
| B、它们都能与水反应 |
| C、钠原子、钠离子均为同一元素,因此是同种微粒 |
| D、灼烧时,它们的焰色反应都呈紫色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com