
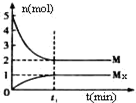
 E是非金属性最强的元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下关系:xM(g)?Mx(g),反应物和生成物的物质的量随时间的变化关系如图.下列说法正确的是( )
E是非金属性最强的元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下关系:xM(g)?Mx(g),反应物和生成物的物质的量随时间的变化关系如图.下列说法正确的是( )| A、该反应的化学方程式是2HF?(HF)2 | ||
B、t1时刻,保持温度不变,再充入1molM,重新达到平衡时,
| ||
| C、平衡时混合气体的平均摩尔质量是33.3 | ||
| D、M的沸点比同主族下一周期元素的气态氢化物沸点低 |


科目:高中化学 来源: 题型:
| HCl |
| NH3?H2O |
| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子半径:Al3+<Mg2+<F- |
| B、酸性:H2SiO3<H3PO4<H2SO4<HClO4 |
| C、热稳定性:HI>HBr>HCl>HF |
| D、碱性:NaOH>Mg(OH)2>Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应过程中,气体的密度始终不变 |
| B、当容器中气体压强不变时,反应达到平衡 |
| C、升高温度,v(正)增大、v(逆)减小,平衡向正反应方向移动 |
| D、当2v正(X)=v逆(Z)时,反应达平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(SO3)=4 mol?L-1?min-1 |
| B、v(O2)=2 mol?L-1?min-1 |
| C、v(SO2)=5 mol?L-1?min-1 |
| D、v(SO2)=0.1 mol?L-1?S-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| △ |
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| SO2 | O2 | SO2 | O2 | |||
| 1 | T1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | 4 | 2 | 0.4 | y | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com