
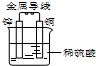
| A、氢离子在负极得电子 |
| B、锌为负极,发生氧化反应 |
| C、铜片上无气泡产生 |
| D、电子从铜片经金属导线流向锌片 |


科目:高中化学 来源: 题型:
| A、BaCl2溶液和K2SO4溶液反应 |
| B、点燃H2和O2的混合气体 |
| C、NaOH溶液和CuSO4溶液反应 |
| D、Zn放入盐酸中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应过程中,气体的密度始终不变 |
| B、当容器中气体压强不变时,反应达到平衡 |
| C、升高温度,v(正)增大、v(逆)减小,平衡向正反应方向移动 |
| D、当2v正(X)=v逆(Z)时,反应达平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| △ |
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| SO2 | O2 | SO2 | O2 | |||
| 1 | T1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | 4 | 2 | 0.4 | y | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应是放热还是吸热要由反应物和生成物所具有的总能量来决定 |
| B、需要加热才能发生的反应可能是吸热反应也可能是放热反应 |
| C、放热的反应在常温下一定很容易发生 |
| D、反应热可用量热计测量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A的最简单氢化物 | B的最简单氢化物 | M的最简单氢化物 | X的氧化物 | Y的最简单氢化物 | Z的最高价氧化物 |
| 含氢量最高的有机物 | 水溶液呈碱性 | 水溶液呈酸性 | 两性氧化物 | 分子呈正四面体构型 | 对应水化物为最强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④ | B、①②⑤ | C、②④ | D、③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com