
| A、升高体系的温度 |
| B、增加体系的压强 |
| C、减少C的物质的量 |
| D、增加A的物质的量 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 元素 | A | B | C | D |
| 性质结构信息 | 原子核外有两个电子层,最外层有3个未成对的电子 | 原子的M层有1对成对的p电子 | 原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
| CH3COOH | 1.8×10-5 | H3PO4 | K1=7.1×10-3 |
| H3PO3 | K1=3.7×10-2 | K2=6.2×10-8 | |
| K2 =2.9×10-7 | K3=4.5×10-13 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
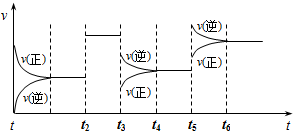
| A、t2时加入了催化剂 |
| B、t3时降低了温度 |
| C、t5时增大了压强 |
| D、该反应最初是从逆反应开始的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
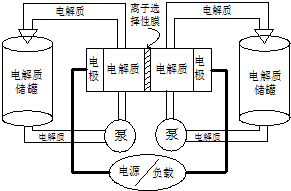 如图是一种正在投入生产的大型蓄电系统.左右两侧为电解质储罐,中央为电池,电解质通过泵不断在储罐和电池间循环;电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜可允许钠离子通过;放电前,被膜隔开的电解质为Na2S2(右罐)和NaBr3(左罐),放电后,分别变为Na2S4和NaBr.下列说法正确的是( )
如图是一种正在投入生产的大型蓄电系统.左右两侧为电解质储罐,中央为电池,电解质通过泵不断在储罐和电池间循环;电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜可允许钠离子通过;放电前,被膜隔开的电解质为Na2S2(右罐)和NaBr3(左罐),放电后,分别变为Na2S4和NaBr.下列说法正确的是( )| A、电池充电时,阳极电极反应式为:3Br--2e-=Br3- |
| B、电池放电时,负极电极反应式为:2S22-+2e-═S42- |
| C、电池放电时,电池的总反应方程式为:Na2S4+3NaBr=2Na2S2+NaBr3 |
| D、在充电过程中Na+通过膜的流向为从右到左 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁和稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
| B、实验室用大理石与盐酸反应制取二氧化碳:CO32-+2H+=CO2↑+H2O |
| C、碳酸钡溶于稀硝酸:BaCO3+2H+=Ba2++CO2↑+H2O |
| D、铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com