
| n(OH-)-n(H+) |
| V(酸)+V(碱) |
| 0.01mol/L×0.1L |
| 0.001mol/L |
| 0.01mol/L×0.1L-0.008mol/LL×V |
| 0.1L+V |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
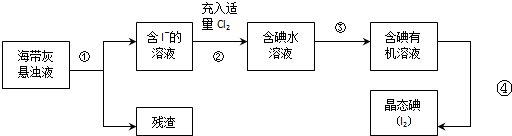
查看答案和解析>>
科目:高中化学 来源: 题型:
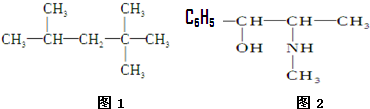
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO32-+H2O?HCO3-+OH-;用热的纯碱溶液清洗油污 |
| B、Al3++3H2O?Al(OH)3(胶体)+3H+;明矾净水 |
| C、TiCl4+(x+2)H2O(过量)?TiO2?xH2O↓+4HCl;制备TiO2纳米粉 |
| D、SnCl2+H2O?Sn(OH)Cl↓+HCl;配制氯化亚锡溶液时加入氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
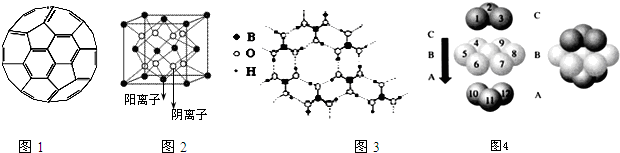
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com