
【题目】某酸式盐NaHY的水溶液显碱性,下列叙述不正确的是
A.H2Y的电离方程式:H2Y![]() 2H+ + Y2-
2H+ + Y2-
B.HY- 水解的离子方程式:HY- + H2O![]() H2Y + OH-
H2Y + OH-
C.该酸式盐溶液中离子浓度大小关系:c(Na+) > c(HY-)>c(OH-) >c(H+)
D.该酸式盐溶液中微粒浓度关系:c(H+)+c(H2Y) = c(OH-)+c(Y2-)
科目:高中化学 来源: 题型:
【题目】下列属于氧化还原反应的是
A. 2NaHCO3![]() Na2CO3+CO2↑+H2O B. Na2O+H2O=2NaOH
Na2CO3+CO2↑+H2O B. Na2O+H2O=2NaOH
C. 2KI+Br2=2KBr+I2 D. MgO+2HCl=MgCl2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用钛白粉厂废酸(主要含硫酸、Fe3+、Fe2+、TiO2+、Al3+)制备过二硫酸铵[(NH4)2S2O8],同时回收TiO(OH)2的简要流程如下:
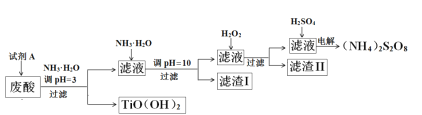
已知:i.部分离子完全生成氢氧化物沉淀的pH
金属离子 | TiO2+ | Fe3+ | Fe2+ | Al3+ |
开始沉淀的PH | 1.2 | 1.9 | 7.0 | 3.2 |
沉淀完全的pH | 2.8 | 3.1 | 9.4 | 4.7 |
ii.pH>7时,Fe2+部分生成Fe(II)氨络离子[Fe(NH3)2]2+。
请回答下列问题:
(1)为保证产物TiO(OH)2的纯度,加入试剂A要适量。试剂A为___________。
(2)煅烧回收的TiO(OH)2,获得的TiO2会发黄,发黄的杂质可能是_______(填化学式)。
(3)滤渣I的主要成分除Fe(OH)2、Al(OH)3外,还含有______________。
(4)加入H2O2的目的是氧化除掉Fe(II)氨络离子[Fe(NH3)2]2+,配平下列离子方程式:2[Fe(NH3)2]2+ +________+4H2O +H2O2 =_______ + 4NH3·H2O
(5)电解制备过二硫酸铵的装置如下图所示。
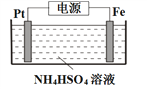
①S2O82-中S元素的化合价为+6,其中过氧键的数目为___________。
②电解时,铁电极连接电源的___________极。
③常温下,电解液中含硫微粒主要存在形式与 pH 的关系如下图所示。
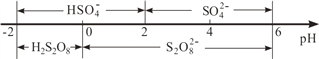
在阳极放电的离子主要为HSO4-,阳极区电解质溶液的 pH 范围为______,阳极的电极反应式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,加热等物质的量的NaHCO3和Na2O2的固体混合物,充分反应后,容器中固体剩余物是( )
A. Na2CO3和Na2O2 B. Na2CO3和NaOH
C. NaOH和Na2O2 D. NaOH、Na2O2和Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化合物:①Na2O2、②Fe(OH)3、③FeCl2、④CuS、⑤H2SiO3、⑥NaHCO3,其中不能通过化合反应制得的有几项?
A. 一项 B. 二项 C. 三项 D. 四项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为 NA,下列说法正确的是( )
A. 0.1 mol NaHSO4 晶体中。含有 H+的数目为 0.1NA
B. 28g 乙烯和丙烯(CH2=CHCH3)混合气体中含共价单键的数目为 4NA
C. 1L 0.1 mol/L 的 Na2CO3 溶液中 CO32-和HCO3- 离子数目之和为 0.1NA
D. 质量均为 20g 的 1H218O 与 D2O 中所含中子数均为 10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气的制取与储存是氢能源利用领域的研究热点。回答下列问题:
(1)直接热分解法制氢
某温度下2H2O(g) ![]() 2H2(g) +O2(g),该反应的平衡常数表达式为 K= ________。
2H2(g) +O2(g),该反应的平衡常数表达式为 K= ________。
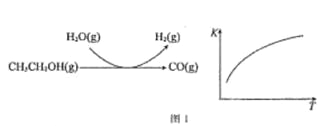
(2)乙醇水蒸气重整制氢
反应过程和反应的平衡常数(K)随温度(T)的变化曲线如图 1 所示。某温度下,图 1 所示反应每生成1mol H2(g),热量变化是 62 kJ,则该反应的热化学方程式为________________
(3)水煤气法制氢
CO(g)+ H2O(g) ![]() CO2(g) +H2(g) △H<0,在进气比[n(CO):n(H2O)]不同时,测得相应的 CO 的平衡转化率见图 2(图中各点对应的反应温度可能相同,也可能不同)。
CO2(g) +H2(g) △H<0,在进气比[n(CO):n(H2O)]不同时,测得相应的 CO 的平衡转化率见图 2(图中各点对应的反应温度可能相同,也可能不同)。
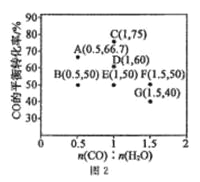
①向 2 L 恒温恒容密闭容器中加入一定量的 CO 和 0.1mol H2O(g),在图中 G 点对应温度下,反应经5 min 达到平衡,则平均反应速率 v(CO)=___________。
②图中 B、E 两点对应的反应温度分别为 TB 和 TE,则 TB ___________TE (填“>”“ <”或“=”)。
③经分析,A、E、G 三点对应的反应温度都相同(均为 T℃),其原因是 A、E、G 三点对应的 _______相同。
④当 T℃时,若向一容积可变的密闭容器中同时充入 3.0 mol CO、1.0 mol H2O(g)、1.0 molCO2 和xmol H2,使上述反应开始时向正反应方向进行,则x应满足的条件是_________。
(4)光电化学分解制氢

反应原理如图3,钛酸锶光电极的电极反应式为 4OH--4e-=O2↑+2H2O,则铂电极的电极反应式为 ________。
(5)Mg,Cu 是一种储氢合金
350℃时,Mg、Cu 与 H2 反应,生成 MgCu2 和仅含一种金属元素的氢化物(其中氢的质量分数约为 7.7%)。该反应的化学方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下实验能获得成功的是( )
A.用稀硫酸与乙醇混合液共热控制在170℃制乙烯气体
B.将铁屑、溴水、苯混合制溴苯
C.在苯酚溶液中滴入少量稀溴水出现白色沉淀
D.将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验设计及其对应的离子方程式均正确的是
A. 用FeCl3溶液腐蚀铜箔制作印刷电路板:Fe3++Cu=Cu2++Fe3+
B. 用Na2CO3溶液处理水垢中的CaSO4:CO32-+CaSO4![]() CaCO3+SO42-
CaCO3+SO42-
C. 碳酸钠溶液显碱性:CO32-+2H2O=HCO3-+2OH-
D. 用NaOH溶液吸收氯气:Cl2+2OH-=2Cl-+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com