
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH,如下表:
| 实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
(1)HA是弱酸;(1分)
(2) >(1分); c(A-)=c(Na+)(1分)
(3)>(1分); c(A-) >c(Na+) >c(H+)> c(OH-)(1分)
(4)10 -5(1分); 10 -5-10 -9(2分);10 -9(2分)
解析试题分析:(l)根据表中数据可知,当二者恰好反应时,溶液显碱性。这说明生成的NaA水解,溶液显碱性,由此可知 HA是弱酸。
(2)HA是弱电解质,如果二者恰好反应,溶液显示碱性。若要使pH=7,则加入的HA应该过量,故应该大c>0.2mol/L。pH=7,氢离子等于氢氧根浓度,根据电荷守恒c(Na+)+c(H+)= c(A-)+ c(OH-),由此c(A-)=c(Na+)。
(3)根据③的结果可知,反应后HA是过量的,由此混合液是由等物质的量浓度的HA和NaA组成的。溶液显酸性,说明A-的水解程度小于HA的电离程度,所以溶液中离子浓度大小关系为c(A-) >c(Na+) >c(H+)> c(OH-)。
(4)强碱弱酸盐溶液中,弱酸根结合水电离的氢离子,溶液显示碱性,溶液中的氢氧根就是水电离出来的,所以①组实验所得混合溶液中由水电离出的c(OH-)=10-14÷10-9=10-5mol/L;根据电荷守恒c(Na+)+c(H+)= c(A-)+ c(OH-),故c(Na+)-c(A-)=c(OH-)-c(H+)=(10-5-10-9)mol/L;根据物料守恒可知c(Na+)=c(HA)+c(A-),带人电荷守恒c(Na+)+c(H+)= c(A-)+ c(OH-),得c(OH-)-c(HA)=c(H+)=10-9mol/L。
考点:考查弱电解质在水溶液中的电离平衡;盐类水解的原理;离子浓度大小的比较


科目:高中化学 来源: 题型:填空题
物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学的知识回答:下表是不同温度下水的离子积数据:
| 温度 / ℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)水的电离平衡曲线如图所示,若A点表示25 ℃时水的电离达平衡时的离子浓度,B点表示95 ℃时水的电离达平衡时的离子浓度。则95℃时0.1 mol·L-1的NaOH溶液中,由水电离出的 c(H+)= mol·L-1,Kw(25 ℃) Kw(95℃)(填“>”、“<”或“=”)。25 ℃时,向水的电离平衡体系中加入少量NH4Cl 固体,对水的电离平衡的影响是 (填“促进”、“抑制”或“不影响”)。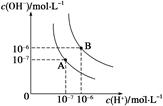
(2)25℃时,在0.1L 0.2 mol·L-1的HA溶液中,有0.001mol的HA电离成离子,则该溶液的pH= ,电离度为 。
(3)电离平衡常数是衡量弱电解质电离程度强弱的量(已知如表数据)。向NaCN溶液中通入少量CO2,所发生反应的化学方程式为 。
| 化学式 | 电离平衡常数(25 ℃) |
| HCN | K=4.9×10-10 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
为了证明醋酸是弱电解质,甲、乙、丙、三人分别选用下列试剂进行实验:
0.1 mol·L-1醋酸溶液、pH=3的盐酸、pH=3的醋酸、、蒸馏水、锌粒、pH试纸等。
(1)甲取出10 mL0.1 mol·L-1醋酸溶液,用pH试纸测出其pH=a,确定醋酸是弱电解质,则a应该满足的关系是_________,理由是__________________________________。
(2)乙将pH=3醋酸和盐酸,各取1 mL,用蒸馏水稀释到100 mL,然后用pH试纸
分别测定两溶液的pH,则可认定醋酸是弱电解质,判断的依据是______________________________。
(3)丙分别取pH=3的盐酸和醋酸10 mL,然后分别加入质量相同的锌粒,醋酸放出H2的平均速率 (填“快”或“慢”),则认定醋酸是弱电解质,。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有X、Y、Z、W四种物质的水溶液,它们分别是Na2CO3、NaOH、CH3COOH和NaCl中的一种。已知X、Y两溶液中水的电离程度相同,X、Z两溶液的pH相同,请回答下列问题:
(1)X是 ,Z是 ;
(2)Z、W两溶液中水的电离程度由大到小的顺序为 (用化学式表示);
(3)写出Z溶液与过量Y溶液反应的离子方程式 ;
(4)X、Y两溶液恰好完全反应后,溶液中各离子浓度由大到小的顺序是
。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
科研、生产中常涉及钠、硫及其化合物。
(1)工业上用Na2CO3溶液处理水垢中的CaSO4,反应的离子方程式为___________________;实验室中,Na2S溶液长期放置有硫析出,原因为___________________(用离子方程式表示)。
(2)下图是大型蓄电系统的示意图。左右两侧为电解质储罐,中央为电池,反应原理为: ,电解质通过泵在储罐和电池间循环;离子选择性膜只允许钠离子通过。
,电解质通过泵在储罐和电池间循环;离子选择性膜只允许钠离子通过。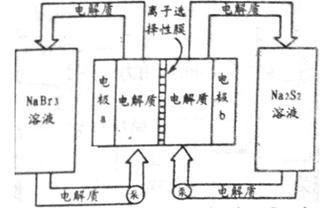
当蓄电池放电时,电池中Na+的移动方向是_________(填“a→b”或“b→a”),电极a的电极反应式为_______________;当蓄电池处于充电状态时,电极b的电极反应式为___________。用该电池做电源,采用惰性电极电解200 mL 1 mol·L-1的AgNO3溶液,当阴极质量增加2.16 g时,电解后溶液的pH为_________(不考虑溶液体积变化)。
(3)工业上,用Na2SO3溶液作为吸收液可吸收烟气中的SO2,吸收SO2过程中,溶液pH与 关系如下表:
关系如下表:
 | 91∶9 | 1∶1 | 9∶91 |
| pH(25℃) | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)大气中SO2含量过高会导致雨水中含有(填化学式) 而危害植物和建筑物。工厂排放的SO2尾气用饱和Na2SO3溶液吸收可得到重要化工原料NaHSO3,反应的化学方程式为 。
(2)已知NaHSO3的水溶液显酸性,比较其中SO32-、HSO3-、H2SO3三种粒子的浓度: > > 。
(3)SO2是空气质量报告的指标之一,可用SO2还原KIO3生成I2的反应测定空气中SO2含量。每生成0.01mol I2,参加反应的SO2为 mol。
(4)已知25℃时,Ksp(BaSO4)=1.1×10-10,Ksp (BaCO3)=2.6×10-9。下列说法不正确的是
A.25℃时,向BaSO4悬浊液中加入大量水,Ksp(BaSO4)不变
B.25℃时,向BaSO4悬浊液中加入Na2CO3溶液后,BaSO4不可能转化为BaCO3
C.向Na2SO4中加入过量BaCl2溶液后,溶液中c(SO42-)降低为零
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
铁是地壳中含量第二的金属元素,其单质、合金化合物在生产生活中的应用广泛。
(一)工业废水中有一定量的Cr2O72--和CrO42-,它们会对人类及生态系统产生很大的危害,必须进行处理。常用的处理方法是电解法,该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解的进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(1)用Fe作电极的目的是____________________________________________________。
(2)阴极附近溶液pH升高的原因是___________(用电极反应式解释);溶液中同时生成的沉淀还有___________。
(二)氮化铁磁粉是一种磁记录材料,利用氨气在400℃以上分解得到的氮原子渗透到高纯铁粉中可制备氮化铁。制备高纯铁涉及的主要生产流程如下: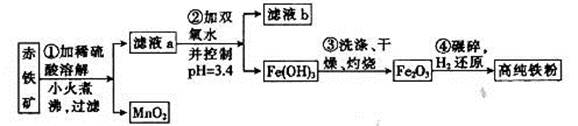
已知:①某赤铁矿石含60.0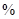 Fe2O3、3.6% FeO,还含有Al2O3、MnO2、CuO等。
Fe2O3、3.6% FeO,还含有Al2O3、MnO2、CuO等。
②部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
(3)步骤②中加双氧水的目的是__________________,pH控制在3.4的作用是_______________________;已知25℃时,Ksp[Cu(OH) 2] =2.0×10-20,该温度下反应:Cu2++2H2O Cu(OH) 2+2H+的平衡常数K=_______。
Cu(OH) 2+2H+的平衡常数K=_______。
(4)如何判断步骤③中沉淀是否洗涤干净?_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平衡,且改变条件平衡发生移动。实验方案如下:
甲:取纯度相同,质量、大小相等的锌粒于两支试管中,同时加入 0.1 mol·L-1的HA溶液、稀盐酸各10 mL,按图装好,观察现象。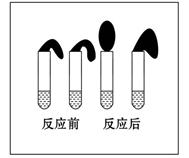
乙:① 用pH计测定浓度均为0.1 mol·L-1的HA溶液和稀盐酸的pH;
② 再取0.1 mol·L-1的HA溶液和稀盐酸各2滴(1滴约为1/20 mL)分别稀释至100 mL,再用pH计测其pH变化。
(1)乙的方案中说明HA是弱电解质的理由是:测得0.1 mol·L-1的HA溶液的
pH 1(填“>”、“<”或“=”);甲方案中,说明HA是弱电解质的实验现象是:
(填序号)
A.加入两种稀酸后,两个试管上方的气球同时鼓起,且一样大
B.加入HA溶液后,试管上方的气球鼓起慢
C.加入稀盐酸后,试管上方的气球鼓起慢
(2) 乙同学设计的实验第 步,能证明改变条件弱电解质平衡发生移动。甲同学为了进一步证明弱电解质电离平衡移动的情况,设计如下实验:
①使HA的电离程度和c(H+)都减小,c(A-)增大,可在0.1 mol·L-1的HA溶液中,选择加入 试剂(选填“A”、“B”、“C”或“D”,下同);
②使HA的电离程度减小,c(H+)和c(A-)都增大,可在0.1 mol·L-1的HA溶液中,选择加入 试剂。
A.NaA固体(可完全溶于水)
B.1 mol·L-1 NaOH溶液
C.1 mol·L-1 H2SO4
D.2 mol·L-1 HA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com