
【题目】已知A(g)+B(g) ![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K= ____________,ΔH__0(填“<”“ >”或“ =”)。
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1,则6s时C的物质的量为_____;则反应达到平衡时,A的转化率为____,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为_____(填“增大”“减少”或“不变”)。
(3)1200℃时反应C(g)+D(g) ![]() A(g)+B(g)的平衡常数的值为_______。
A(g)+B(g)的平衡常数的值为_______。
【答案】(1) ![]() < 0.09mol 80% 不变 2.5
< 0.09mol 80% 不变 2.5
【解析】
(1)化学平衡常数等于生成物浓度幂次方的乘积与反应物浓度幂次方乘积的比值;由表中数据可知,温度升高平衡常数降低,平衡向逆反应方向移动,故正反应为放热反应;
(2)根据反应初始6s内A的平均反应速率计算6s内△c(A),进而计算△n(A),再根据方程式可知n(C)=△n(A);设平衡时A的浓度变化量为x,列出三段式,结合830℃时,平衡常数等于1列方式解未知数,计算平衡x的转化量,进而计A的转化率;如果这时向该密闭容器中再充入1 mol氩气,反应体系中各物质的浓度均不变,平衡不移动;
(3)同一反应在相同温度下,正、逆反应的平衡常数互为倒数。
(1)化学平衡常数等于生成物浓度幂次方的乘积与反应物浓度幂次方乘积的比值,则该反应的平衡常数的表达式为K=![]() ;由表中数据可知,温度升高平衡常数降低,平衡向逆反应方向移动,故正反应为放热反应,即△H<0;
;由表中数据可知,温度升高平衡常数降低,平衡向逆反应方向移动,故正反应为放热反应,即△H<0;
故答案为:![]() ;<;
;<;
(2)反应初始6s内A的平均反应速率v(A)=0.003molL1s1,则6s内△c(A)=0.003molL1s1×6s=0.018mol/L,A的起始浓度为![]() ,故6s内△n(A)=0.018mol/L×5L=0.09mol,由方程式可知n(C)=△n(A)=0.09mol,
,故6s内△n(A)=0.018mol/L×5L=0.09mol,由方程式可知n(C)=△n(A)=0.09mol,
设平衡时A的浓度变化量为x,则可列三段式:
A(g) + B(g) C(g) + D(g)
开始(mol/L): 0.04 0.16 0 0
变化(mol/L): x x x x
平衡(mol/L): 0.04x 0.16x x x
830℃时,平衡常数等于1,则![]() ,解得x=0.032mol,则平衡时A的转化率为
,解得x=0.032mol,则平衡时A的转化率为![]() ;如果这时向该密闭容器中再充入1 mol氩气,反应体系中各物质的浓度均不变,平衡不移动,则A的转化率不变;
;如果这时向该密闭容器中再充入1 mol氩气,反应体系中各物质的浓度均不变,平衡不移动,则A的转化率不变;
故答案为:0.09mol;80%;不变;
(3)同一反应在相同温度下,正、逆反应的平衡常数互为倒数,故1200℃时反应C(g)+D(g)A(g)+B(g)的平衡常数的值为![]() ;
;
故答案为:2.5。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】从某含有FeCl2、FeCl3、CuCl2的工业废液中回收铜并制备氯化铁晶体的流程如下:
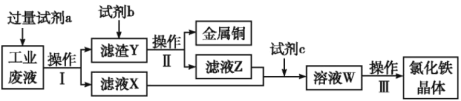
则下列说法正确的是( )
A.试剂a是铁、试剂b是稀硫酸
B.操作Ⅰ、操作Ⅱ、操作Ⅲ所用仪器相同
C.试剂c是氯气,相应的反应为2Fe2++Cl2═2Fe3++2Cl-
D.用酸性KMnO4溶液可检验溶液W中是否含有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25mL 0.1mol·L-1NaOH溶液中逐滴加入0.2mol·L-1CH3COOH溶液,溶液pH变化曲线如图所示,下列有关离子浓度的比较正确的是

A.在A、B间任一点(不含A、B点),溶液中可能有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点,c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.在D点,c(CH3COO-)+c(CH3COOH)=c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素原子的核电荷数依次增大![]() 均小于
均小于![]() ,其单质及相应的化合物能发生如下反应关系:
,其单质及相应的化合物能发生如下反应关系:
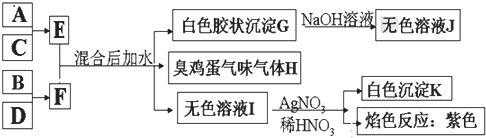
(1)写出F的电子式 ______ 。
(2)气体H有毒,可用![]() 溶液吸收,生成两种酸式盐,该反应的化学方程式为: ______ 。
溶液吸收,生成两种酸式盐,该反应的化学方程式为: ______ 。
(3)加热E的水溶液后并灼烧,最终得到的固体为 ______ ,原因为 ______ 、 ______ ![]() 用化学反应方程式来表示
用化学反应方程式来表示![]() 。
。
(4)室温下,向F的水溶液中加入等体积等浓度的盐酸反应后所得溶液的![]() ,则此溶液中离子浓度由小到大的顺序为: ______ 。
,则此溶液中离子浓度由小到大的顺序为: ______ 。
(5)将气体H放在空气中充分燃烧可得到气体氧化物![]() ,
,![]() 可与氧气继续反应:
可与氧气继续反应:![]() ,在一个固定容积为2L的密闭容器中充入
,在一个固定容积为2L的密闭容器中充入![]() 的
的![]() 和
和![]() 的
的![]() ,半分钟后达到平衡,测得容器中含
,半分钟后达到平衡,测得容器中含![]() 为0.18mol,则υ(O2)=______ mol/(L·min),若继续通入
为0.18mol,则υ(O2)=______ mol/(L·min),若继续通入![]()
![]() 和
和![]()
![]() ,再次达到新平衡后,
,再次达到新平衡后,![]() 的物质的量介于 ______ 之间。
的物质的量介于 ______ 之间。
(6)写出E和F反应的化学反应方程式: ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,下列反应不可能自发进行的是
A.2O3(g)=3O2(g) △H<0
B.CaCO3(s)=CaO(s)+CO2(g) △H>0
C.N2(g)+3H2(g) ![]() 2NH3(g) △H<0
2NH3(g) △H<0
D.2CO(g)=2C(s)+O2(g) △H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量的浓度和混合液的pH如下表所示:
实验编号 | HA的物质的量浓度(mol·L-1) | NaOH的物质的量浓度(mol·L-1) | 混合后溶液的pH |
甲 | 0.1 | 0.1 | pH=a |
乙 | 0.12 | 0.1 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还弱酸? 。
(2)乙组混合溶液中离子浓度c(A-)和c(Na+)的大小关系是 。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是 。
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)= mol/L。
Ⅱ.某二元酸(分子式用H2B表示)在水中的电离方程式是:H2B=H++HB-;HB-![]() H++B2-
H++B2-
回答下列问题:
(5)在0.1 mol/L的Na2B溶液中,下列粒子浓度关系式正确的是 。
A.c(B2-)+c(HB-)=0.1mol/L
B.c(B2-)+c(HB-)+c(H2B)=0.1mol/L
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法可以证明反应![]()
![]() 已达到平衡状态的是
已达到平衡状态的是![]()
A.1个![]() 分解的同时,有3个
分解的同时,有3个![]() 的形成
的形成
B.1个![]() 分解的同时,有3个
分解的同时,有3个![]() 的分解
的分解
C.1个![]() 分解的同时,有1个
分解的同时,有1个![]() 的分解
的分解
D.1个![]() 分解的同时,有2个
分解的同时,有2个![]() 的形成
的形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向100mL 1molL﹣1H2SO3溶液中逐渐滴入1molL﹣1的NaOH溶液,含硫物质的分布分数δ(平衡时某物质的浓度与各物质浓度之和的比)与pH的关系如图所示(已知:pKs=﹣lgK,25℃时,H2SO3的pKa1=1.85,pKa2=7.19).下列说法不正确的是( )
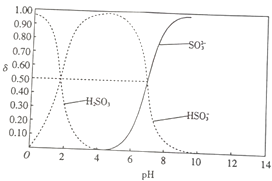
A.pH=1.85时,c(H2SO3)=c(HSO3﹣)
B.pH=6时,c(Na+)>c(HSO3﹣)>c(SO32﹣)
C.pH=7.19时,c(Na+)+c(H+)=c(HSO3﹣)+2c(SO3﹣)+c(OH﹣)
D.加入150mLNaOH溶液时,3c(Na+)=2c(H2SO3)+2c(HSO3﹣)+2c(SO32﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白。NaClO2在溶液中可生成ClO2、HClO2、ClO2-、Cl-等四种含氯微粒,经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出)。则下列分析不正确的是
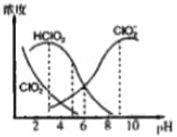
A. 亚氯酸钠在碱性条件下较稳定
B. 25℃时,HClO2的电离平衡常数的数值Ka=10-6
C. 25℃,pH=3时NaClO2溶液中c(Na+)+c(H+)=c(ClO2-)+c(OH-)
D. 若浓度均为0.1mol/L的HClO2溶液和NaClO2溶液等体积混合后所得溶液显酸性,溶液中有关微粒的浓度由大到小的顺序为c(ClO2-)>c(Na+)>c(HClO2)>c(H+)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com