
【题目】A、B、C、D四种元素原子的核电荷数依次增大![]() 均小于
均小于![]() ,其单质及相应的化合物能发生如下反应关系:
,其单质及相应的化合物能发生如下反应关系:
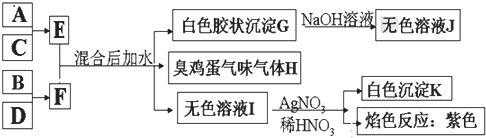
(1)写出F的电子式 ______ 。
(2)气体H有毒,可用![]() 溶液吸收,生成两种酸式盐,该反应的化学方程式为: ______ 。
溶液吸收,生成两种酸式盐,该反应的化学方程式为: ______ 。
(3)加热E的水溶液后并灼烧,最终得到的固体为 ______ ,原因为 ______ 、 ______ ![]() 用化学反应方程式来表示
用化学反应方程式来表示![]() 。
。
(4)室温下,向F的水溶液中加入等体积等浓度的盐酸反应后所得溶液的![]() ,则此溶液中离子浓度由小到大的顺序为: ______ 。
,则此溶液中离子浓度由小到大的顺序为: ______ 。
(5)将气体H放在空气中充分燃烧可得到气体氧化物![]() ,
,![]() 可与氧气继续反应:
可与氧气继续反应:![]() ,在一个固定容积为2L的密闭容器中充入
,在一个固定容积为2L的密闭容器中充入![]() 的
的![]() 和
和![]() 的
的![]() ,半分钟后达到平衡,测得容器中含
,半分钟后达到平衡,测得容器中含![]() 为0.18mol,则υ(O2)=______ mol/(L·min),若继续通入
为0.18mol,则υ(O2)=______ mol/(L·min),若继续通入![]()
![]() 和
和![]()
![]() ,再次达到新平衡后,
,再次达到新平衡后,![]() 的物质的量介于 ______ 之间。
的物质的量介于 ______ 之间。
(6)写出E和F反应的化学反应方程式: ______ 。
【答案】![]()
![]()
![]()
![]() 2Al(OH)3
2Al(OH)3![]() Al2O3+3H2O c(S2-)<c(H+)<c(OH-)<c(HS-)<c(Cl-)<c(K+)
Al2O3+3H2O c(S2-)<c(H+)<c(OH-)<c(HS-)<c(Cl-)<c(K+) ![]()
![]() 和
和![]()
![]()
【解析】
A、B、C、D四种元素原子的核电荷数均小于20,G是白色胶状沉淀,溶于氢氧化钠溶液,G为Al(OH)3,J为NaAlO2,H为臭鸡蛋气味的气体,H为H2S,无色溶液I与硝酸银、硝酸反应生成白色沉淀K,K为AgCl,进行焰色反应为紫色,故I为KCl;根据E+F![]() Al(OH)3↓+H2S↑+KCl,结合原子守恒,A、B、C、D四种元素原子的核电荷数依次增大,故A为Al,B为S,C为Cl,D为K,由A+C→E可知,E为AlCl3,由B+D→F可知,F为K2S,据此分析。
Al(OH)3↓+H2S↑+KCl,结合原子守恒,A、B、C、D四种元素原子的核电荷数依次增大,故A为Al,B为S,C为Cl,D为K,由A+C→E可知,E为AlCl3,由B+D→F可知,F为K2S,据此分析。
A、B、C、D四种元素原子的核电荷数均小于20,G是白色胶状沉淀,溶于氢氧化钠溶液,G为Al(OH)3,J为NaAlO2,H为臭鸡蛋气味的气体,H为H2S,无色溶液I与硝酸银、硝酸反应生成白色沉淀K,K为AgCl,进行焰色反应为紫色,故I为KCl;根据E+F![]() Al(OH)3↓+H2S↑+KCl,结合原子守恒,A、B、C、D四种元素原子的核电荷数依次增大,故A为Al,B为S,C为Cl,D为K,由A+C→E可知,E为AlCl3,由B+D→F可知,F为K2S;
Al(OH)3↓+H2S↑+KCl,结合原子守恒,A、B、C、D四种元素原子的核电荷数依次增大,故A为Al,B为S,C为Cl,D为K,由A+C→E可知,E为AlCl3,由B+D→F可知,F为K2S;
(1)F为K2S,属于离子化合物,由钾离子与硫离子构成,电子式为:![]() ;
;
(2)H2S有毒,可用Na2CO3溶液吸收,生成两种酸式盐,为NaHS、NaHCO3,反应方程式为:H2S+Na2CO3=NaHS+NaHCO3;
(3)E为AlCl3,AlCl3的水溶液中存在水解平衡AlCl3+3H2O Al(OH)3+3HCl,加热AlCl3的水溶液,由于HCl的挥发,促进水解得到Al(OH)3,灼烧Al(OH)3,Al(OH)3分解:2Al(OH)3![]() Al2O3+3H2O,最终得到的固体为Al2O3;
Al2O3+3H2O,最终得到的固体为Al2O3;
(4)室温下,向K2S的水溶液中加入等体积等浓度的盐酸,K2S与HCl物质的量相等,发生反应K2S+HCl=KHS+KCl,混合后溶液为等浓度的KHS、KCl溶液,溶液的pH>7,则c(H+)<c(OH-),说明HS-的水解程度大于电离程度,故c(HS-)<c(Cl-),水解程度很小,故c(OH-)<c(HS-),溶液中H+来自水的电离与HS-电离,所以c(S2-)<c(H+),溶液中K+浓度最大,故溶液中离子浓度由小到大的顺序为:c(S2-)<c(H+)<c(OH-)<c(HS-)<c(Cl-)<c(K+);
(5)在一个固定容积为2L的密闭容器中充入0.20mol的SO2和0.10mol的O2,半分钟后达到平衡,测得容器中含SO3为0.18mol,υ(SO3)= =0.18mol/(Lmin),速率之比等于化学计量数之比,故υ(O2 )=
=0.18mol/(Lmin),速率之比等于化学计量数之比,故υ(O2 )=![]() υ(SO3)=
υ(SO3)=![]() ×0.18mol/(Lmin)=0.09mol/(Lmin);
×0.18mol/(Lmin)=0.09mol/(Lmin);
若继续通入0.20mol SO2和0.10mol O2,压强增大,平衡向正反应移动,反应转化率增大,再次达到新平衡后,SO3的物质的量大于0.18mol×2=0.36mol,若0.4molSO2与0.2molO2完全反应,可以生成0.4molSO3,反应物不能完全转化,故SO3小于0.4mol,即SO3的物质的量介于0.36mol和0.40mol之间;
(6)E和F反应生成氢氧化铝、硫化氢和氯化钾,反应的化学反应方程式为:![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知室温时,0.1 mol/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( )
A. 该溶液的pH=4 B. 升高温度,溶液的pH和电离平衡常数均减小
C. 此酸的电离平衡常数约为1×10-7 D. 加入少量纯HA,电离程度减小电离平衡常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】进入冬季北方开始供暖后,雾霾天气愈发严重,各地PM2.5、PM10经常“爆表”。引发雾霾天气的污染物中,最为常见的是机动车尾气中的氮氧化物和燃煤产生的烟气。
I、用NH3催化还原NOx可以消除氮氧化物的污染。反应原理为:NO(g)+NO2(g)+2NH3(g) ![]() 2N2(g)+3H2O(g)。
2N2(g)+3H2O(g)。
(1)该反应的△S________0(填“>”、“=”或“<”)。
(2)II、已知反应N2O4(g) ![]() 2NO2(g) △H,随温度升高,混合气体的颜色变深。将一定量N2O4气体充入绝热容器一段时间后,研究压缩和拉伸活塞过程中混合气体的气体的透光率(气体颜色越浅,透光率越大)随时间变化情况。下列说法能说明透光率不再发生改变的有________。
2NO2(g) △H,随温度升高,混合气体的颜色变深。将一定量N2O4气体充入绝热容器一段时间后,研究压缩和拉伸活塞过程中混合气体的气体的透光率(气体颜色越浅,透光率越大)随时间变化情况。下列说法能说明透光率不再发生改变的有________。
a.气体颜色不再改变b.△H不再改变
c.v正(N2O4)=2v逆(NO2)d.N2O4的转化率不再改变
(3)III、用CH4催化还原NOx也可以消除氮氧化物的污染。
已知:CH4(g)的标准燃烧热为-890kJ/mol,蒸发1mol H2O(l)需要吸收44kJ热量。
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=﹣1114 kJ/mol
2NO(g)+O2(g)=2NO2(g)△H=﹣114 kJ/mol
写出CH4催化还原NO2(g)生成N2和H2O(g)的热化学方程式:________。
(4)在温度为T1℃和T2℃时,分别将0.5mol CH4和1.2mol NO2充入体积为1L的密闭容器中,测得NO2的物质的量随时间变化数据如下表:
温度/℃ | 0 | 10 | 20 | 40 | 50 |
T1 | 1.2 | 0.9 | 0.7 | 0.4 | 0.4 |
T2 | 1.2 | 0.8 | 0.56 | … | 0.5 |
①温度为T1℃时,0~20min内,v(CH4)=________。
②温度为T2℃时,达平衡后,再向容器中加入0.5mol CH4和1.2mol NO2,达新平衡时CH4的转化率将________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH为2的氢氟酸稀释100倍后,pH<4。则250C时,将0.1mol·L-1的HF加水不断稀释,下列表示的量保持不变的是( )
①n(H+); ②c(H+)·c(OH—);③c(OH—)+ c(F—);④![]() ⑤
⑤![]() ;
;
A.①③④B.②③④C.③④⑤D.②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL某浓度的硫酸溶液中滴入0.1mol/L氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图。下列分析正确的是( )
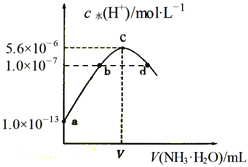
A. V=40
B. c点所示溶液中:c(H+ )-c(OH-)=2c(NH3·H2O)
C. NH3·H2O的电离常数K=10-4
D. d点所示溶液中:c(NH4+)=2c(SO42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知N2(g)+3H2(g)![]() 2NH3(g) △H=-92.3kJ/mol,在一定温度和催化剂的条件下,向一密闭容器中,通入1molN2和3molH2,达到平衡状态I;相同条件下,向另一体积相同的密闭容器中通入0.9molN2、2.7molH2和0.2molNH3,达到平衡状态II,则下列说法正确的是
2NH3(g) △H=-92.3kJ/mol,在一定温度和催化剂的条件下,向一密闭容器中,通入1molN2和3molH2,达到平衡状态I;相同条件下,向另一体积相同的密闭容器中通入0.9molN2、2.7molH2和0.2molNH3,达到平衡状态II,则下列说法正确的是
A.两个平衡状态的平衡常数的关系:KⅠ<KⅡ
B.H2的百分含量相同
C.N2的转化率:平衡I<平衡Ⅱ
D.反应放出的热量:QⅠ=QⅡ<92.3kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A(g)+B(g) ![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K= ____________,ΔH__0(填“<”“ >”或“ =”)。
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1,则6s时C的物质的量为_____;则反应达到平衡时,A的转化率为____,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为_____(填“增大”“减少”或“不变”)。
(3)1200℃时反应C(g)+D(g) ![]() A(g)+B(g)的平衡常数的值为_______。
A(g)+B(g)的平衡常数的值为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中错误的是( )
A.在平衡体系PCl5(g)![]() PCl3(g)+Cl2(g)中加入一定量的37Cl2,一段时间后37Cl存在于五氯化磷、三氯化磷和氯气这三种物质中
PCl3(g)+Cl2(g)中加入一定量的37Cl2,一段时间后37Cl存在于五氯化磷、三氯化磷和氯气这三种物质中
B.CH3COOH与H18O-CH2CH3发生酯化反应是可逆反应,达到平衡后,18O一定仅存在于乙醇和乙酸乙酯分子里,不可能存在于乙酸和水分子里
C.在氧气中完全燃烧后生成物只有CO2和H2O的有机物一定是烃
D.CH2Cl2没有同分异构体的事实证明了甲烷分子是以碳原子为中心的正四面体结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列图像的描述正确的是
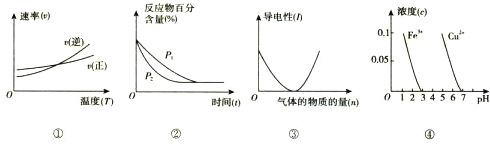
A. 根据图①判断反应A2(g)+3B2(g) ![]() 2AB3(g)的 △H>0
2AB3(g)的 △H>0
B. 图②可表示压强(P)对反应2A(g)+2B(g) ![]() 3C(g)+D(s)的影响
3C(g)+D(s)的影响
C. 图③可表示向醋酸溶液通入氨气时,溶液导电性随氨气量的变化
D. 根据图④,除去CuSO4溶液中的Fe3+,可加入CuO调节pH至3~5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com