
【题目】已知N2(g)+3H2(g)![]() 2NH3(g) △H=-92.3kJ/mol,在一定温度和催化剂的条件下,向一密闭容器中,通入1molN2和3molH2,达到平衡状态I;相同条件下,向另一体积相同的密闭容器中通入0.9molN2、2.7molH2和0.2molNH3,达到平衡状态II,则下列说法正确的是
2NH3(g) △H=-92.3kJ/mol,在一定温度和催化剂的条件下,向一密闭容器中,通入1molN2和3molH2,达到平衡状态I;相同条件下,向另一体积相同的密闭容器中通入0.9molN2、2.7molH2和0.2molNH3,达到平衡状态II,则下列说法正确的是
A.两个平衡状态的平衡常数的关系:KⅠ<KⅡ
B.H2的百分含量相同
C.N2的转化率:平衡I<平衡Ⅱ
D.反应放出的热量:QⅠ=QⅡ<92.3kJ
【答案】B
【解析】
已知N2(g)+3H2(g)![]() 2NH3(g) △H=-92.3kJ/mol,在一定温度和催化剂的条件下,向一密闭容器中,通入1molN2和3molH2,达到平衡状态I;相同条件下,向另一体积相同的密闭容器中通入0.9molN2、2.7molH2和0.2molNH3,转化起始量为1molN2和3molH2,达到平衡状态II和平衡状态I相同;则
2NH3(g) △H=-92.3kJ/mol,在一定温度和催化剂的条件下,向一密闭容器中,通入1molN2和3molH2,达到平衡状态I;相同条件下,向另一体积相同的密闭容器中通入0.9molN2、2.7molH2和0.2molNH3,转化起始量为1molN2和3molH2,达到平衡状态II和平衡状态I相同;则
A、平衡常数随温度变化,两个平衡状态的平衡常数的关系:KI=KII,故A错误;
B、平衡状态II和平衡状态I相同;H2的百分含量相同,故B正确;
C、平衡状态II和平衡状态I相同,N2的转化率:平衡I>平衡II,故C错误;
D、反应是可逆反应不能进行彻底,平衡Ⅱ反应是正逆进行,反应放出的热量:QI>QII都小于92.3 kJ,故D错误;
故选:B。


科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,22.4 L二氯甲烷的共价键数为NA个
B.一定条件下,2 mol SO2和1 mol O2混合在密闭容器中充分反应后容器中的分子数大于2NA
C.含4.8 g碳元素的石墨晶体中的共价键数为1.2NA个
D.2 mL 0.5 mol/L FeCl3溶液滴入沸水中制备Fe(OH)3胶体,所得胶粒数目为0.001NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡态理论认为:化学反应并不是通过简单的碰撞就能完成的,而是从反应物到生成物的过程中经过一个高能量的过渡态。如图1为1molNO2与1molCO恰好反应生成CO2和NO过程中的能量变化示意图

(1)试写出NO2和CO反应的热化学方程式:________
(2)在密闭容器中进行的上述反应是可逆反应,图2是某学生模仿图1画出的NO+CO2 =NO2+CO的能量变化示意图。则图中E3=________kJmol-1
(3)在密闭容器中充入1molH2和1molI2 , 压强为p(Pa),并在一定温度下使其发生反应:H2(g)+I2(g)2HI(g)△H<0.保持容器内气体压强不变,向其中加入1molN2 , 反应速率________(填“变大”、“变小”或“不变”),平衡________移动(填“向正反应方向”、“向逆反应方向”或“不”)。
(4)T℃,向1L密闭容器中加入1molHI(g),发生反应2HIH2+I2, H2物质的量随时间的变化如图3所示。
①该温度下,2HI(g)H2(g)+I2(g)的平衡常数K=________
②相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则________是原来的2倍。
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.2mol/L一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是

A. HA是强酸
B. 该混合液pH=7
C. 图中x表示HA,Y表示OH-,Z表示H+
D. 该混合溶液中:c(A-)+c(Y)=c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素原子的核电荷数依次增大![]() 均小于
均小于![]() ,其单质及相应的化合物能发生如下反应关系:
,其单质及相应的化合物能发生如下反应关系:
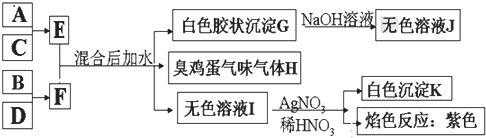
(1)写出F的电子式 ______ 。
(2)气体H有毒,可用![]() 溶液吸收,生成两种酸式盐,该反应的化学方程式为: ______ 。
溶液吸收,生成两种酸式盐,该反应的化学方程式为: ______ 。
(3)加热E的水溶液后并灼烧,最终得到的固体为 ______ ,原因为 ______ 、 ______ ![]() 用化学反应方程式来表示
用化学反应方程式来表示![]() 。
。
(4)室温下,向F的水溶液中加入等体积等浓度的盐酸反应后所得溶液的![]() ,则此溶液中离子浓度由小到大的顺序为: ______ 。
,则此溶液中离子浓度由小到大的顺序为: ______ 。
(5)将气体H放在空气中充分燃烧可得到气体氧化物![]() ,
,![]() 可与氧气继续反应:
可与氧气继续反应:![]() ,在一个固定容积为2L的密闭容器中充入
,在一个固定容积为2L的密闭容器中充入![]() 的
的![]() 和
和![]() 的
的![]() ,半分钟后达到平衡,测得容器中含
,半分钟后达到平衡,测得容器中含![]() 为0.18mol,则υ(O2)=______ mol/(L·min),若继续通入
为0.18mol,则υ(O2)=______ mol/(L·min),若继续通入![]()
![]() 和
和![]()
![]() ,再次达到新平衡后,
,再次达到新平衡后,![]() 的物质的量介于 ______ 之间。
的物质的量介于 ______ 之间。
(6)写出E和F反应的化学反应方程式: ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绝热容器中发生反应:3Z(s)![]() X(g)+2Y(g)△H=a kJ·mol-1(a>0)。下列说法不正确的是
X(g)+2Y(g)△H=a kJ·mol-1(a>0)。下列说法不正确的是
A.将0.3 mol Z置于容器中充分反应生成气体的物质的量一定小于0.3 mol
B.达到化学平衡状态时,气体平均摩尔质量不变
C.容器中放入3mol Z,达到化学平衡状态时,反应吸收的总热量为a kJ
D.容器温度不变,反应已经达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量的浓度和混合液的pH如下表所示:
实验编号 | HA的物质的量浓度(mol·L-1) | NaOH的物质的量浓度(mol·L-1) | 混合后溶液的pH |
甲 | 0.1 | 0.1 | pH=a |
乙 | 0.12 | 0.1 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还弱酸? 。
(2)乙组混合溶液中离子浓度c(A-)和c(Na+)的大小关系是 。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是 。
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)= mol/L。
Ⅱ.某二元酸(分子式用H2B表示)在水中的电离方程式是:H2B=H++HB-;HB-![]() H++B2-
H++B2-
回答下列问题:
(5)在0.1 mol/L的Na2B溶液中,下列粒子浓度关系式正确的是 。
A.c(B2-)+c(HB-)=0.1mol/L
B.c(B2-)+c(HB-)+c(H2B)=0.1mol/L
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制适当的条件,将反应2Fe3++2I-![]() 2Fe2++I2设计成如图所示的原电池,下列判断错误的是
2Fe2++I2设计成如图所示的原电池,下列判断错误的是
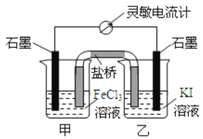
A. 反应开始时,乙中电极反应为2I--2e-=I2
B. 反应开始时,甲中石墨电极上发生还原反应
C. 电流计读数为零时,反应达到化学平衡状态
D. 平衡时乙中溶入碘后,甲池的石墨电极为正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能应用化学平衡移动原理来解释的是
①可用浓氨水和NaOH固体快速制氨气 ②700K左右比室温更有利于合成氨反应
③开启啤酒瓶后,瓶中马上泛起大量泡沫 ④温度升高水的KW增大
⑤对于反应2HI(g) ![]() H2(g)+I2(g)达平衡后,缩小容器体积可使体系颜色变深
H2(g)+I2(g)达平衡后,缩小容器体积可使体系颜色变深
A. ①②③ B. ②④⑤ C. ②⑤ D. ④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com