
【题目】过渡态理论认为:化学反应并不是通过简单的碰撞就能完成的,而是从反应物到生成物的过程中经过一个高能量的过渡态。如图1为1molNO2与1molCO恰好反应生成CO2和NO过程中的能量变化示意图

(1)试写出NO2和CO反应的热化学方程式:________
(2)在密闭容器中进行的上述反应是可逆反应,图2是某学生模仿图1画出的NO+CO2 =NO2+CO的能量变化示意图。则图中E3=________kJmol-1
(3)在密闭容器中充入1molH2和1molI2 , 压强为p(Pa),并在一定温度下使其发生反应:H2(g)+I2(g)2HI(g)△H<0.保持容器内气体压强不变,向其中加入1molN2 , 反应速率________(填“变大”、“变小”或“不变”),平衡________移动(填“向正反应方向”、“向逆反应方向”或“不”)。
(4)T℃,向1L密闭容器中加入1molHI(g),发生反应2HIH2+I2, H2物质的量随时间的变化如图3所示。
①该温度下,2HI(g)H2(g)+I2(g)的平衡常数K=________
②相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则________是原来的2倍。
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
【答案】NO2(g)+CO(g)═NO(g)+CO2(g)△H=-234kJmol-1 368 变小 不 ![]() b
b
【解析】
(1)根据图示能量变化确定反应热,从而写出反应的热化学方程式;
(2)E3表示的是NO和CO2转化为活化状态时所需的能量;
(3)压强不变,充入无关气体,反应容器的体积增大,浓度减小;
(4)①根据图像数据,结合平衡常数的表达式![]() 进行计算;
进行计算;
②若开始加入HI(g)的物质的量是原来的2倍,则浓度也为原来的两倍,结合等效平衡、反应速率的影响因素进行分析;
(1)由反应能量图可知,该反应的反应热ΔH=134kJ/mol-368kJ/mol=-234kJ/mol,故答案为:![]() ;
;
(2)E3表示的是NO和CO2转化为活化状态时所需的能量E3=E2,故答案为:E3=368kJ/mol;
(3)保持容器内气体的压强不变,充入N2,则反应容器的体积变大,各物质浓度减小,反应速率减小;由于该反应在反应前后气体分子数不变,因此平衡不移动,故答案为:变小,不;
(4)①由图像可知,反应达到平衡状态时,n(H2)=0.1mol,则n(I2)=0.1mol,n(HI)=1mol-0.2mol=0.8mol,因此该温度下,反应的平衡常数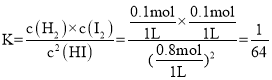 ,故答案为:
,故答案为:![]()
②a、平衡常数只与温度有关,与浓度无关,a项错误;
b、由于该反应中反应前后气体分子数不变,因此反应达到平衡时,c(HI)为原来的两倍,b项正确;
c、c(HI)增大,反应速率,反应达到平衡所需的时间减小,c错误;
d、由于该反应中反应前后气体分子数不变,为等效平衡,平衡时H2的体积分数不变,d项错误;
故答案为b。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知反应C(s)+H2O(g) ![]() CO(g)+H2(g) ΔH在一定温度和压强下于密闭容器中达到平衡。下列叙述正确的是( )
CO(g)+H2(g) ΔH在一定温度和压强下于密闭容器中达到平衡。下列叙述正确的是( )
A.升高温度,平衡常数K增大,则ΔH<0
B.缩小容器体积,c(CO)减小
C.恒压条件下,充入一定量的氮气,n(H2)增大
D.更换高效催化剂,H2O(g)的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(气)+B(气)![]() 2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7 mol·L-1
其中正确的是:
A.①③B.①④C.②③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见的某反应的化学方程式为a+b→c+d+H2O(未配平,条件略去)。下列叙述不正确的是( )
A. 若a是铁,b是稀硝酸(过量),且a可溶于c溶液中。则a与b反应的离子方程式为 Fe+4H++NO3-=Fe3++NO↑+2H2O
B. 若c,d均为气体,且都能使澄清石灰水变浑浊,则将混合气体通入溴水中,橙色褪去,其褪色过程的离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br-
C. 若c是无色刺激性气味的气体,其水溶液呈弱碱性。在标准状况下用排空气法收集c气体得平均摩尔质量为20g·mo1-1的混合气体进行喷泉实验。假设溶质不扩散,试验完成后所得溶液的物质的量浓度约为0.056mo1·L-1
D. 若a是造成温室效应的主要气体之一,c、d均为钠盐,参加反应的a、b物质的量之比为4:5,则上述反应的离子方程式为4CO2+5OH-=CO32+3HCO3-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】进入冬季北方开始供暖后,雾霾天气愈发严重,各地PM2.5、PM10经常“爆表”。引发雾霾天气的污染物中,最为常见的是机动车尾气中的氮氧化物和燃煤产生的烟气。
I、用NH3催化还原NOx可以消除氮氧化物的污染。反应原理为:NO(g)+NO2(g)+2NH3(g) ![]() 2N2(g)+3H2O(g)。
2N2(g)+3H2O(g)。
(1)该反应的△S________0(填“>”、“=”或“<”)。
(2)II、已知反应N2O4(g) ![]() 2NO2(g) △H,随温度升高,混合气体的颜色变深。将一定量N2O4气体充入绝热容器一段时间后,研究压缩和拉伸活塞过程中混合气体的气体的透光率(气体颜色越浅,透光率越大)随时间变化情况。下列说法能说明透光率不再发生改变的有________。
2NO2(g) △H,随温度升高,混合气体的颜色变深。将一定量N2O4气体充入绝热容器一段时间后,研究压缩和拉伸活塞过程中混合气体的气体的透光率(气体颜色越浅,透光率越大)随时间变化情况。下列说法能说明透光率不再发生改变的有________。
a.气体颜色不再改变b.△H不再改变
c.v正(N2O4)=2v逆(NO2)d.N2O4的转化率不再改变
(3)III、用CH4催化还原NOx也可以消除氮氧化物的污染。
已知:CH4(g)的标准燃烧热为-890kJ/mol,蒸发1mol H2O(l)需要吸收44kJ热量。
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=﹣1114 kJ/mol
2NO(g)+O2(g)=2NO2(g)△H=﹣114 kJ/mol
写出CH4催化还原NO2(g)生成N2和H2O(g)的热化学方程式:________。
(4)在温度为T1℃和T2℃时,分别将0.5mol CH4和1.2mol NO2充入体积为1L的密闭容器中,测得NO2的物质的量随时间变化数据如下表:
温度/℃ | 0 | 10 | 20 | 40 | 50 |
T1 | 1.2 | 0.9 | 0.7 | 0.4 | 0.4 |
T2 | 1.2 | 0.8 | 0.56 | … | 0.5 |
①温度为T1℃时,0~20min内,v(CH4)=________。
②温度为T2℃时,达平衡后,再向容器中加入0.5mol CH4和1.2mol NO2,达新平衡时CH4的转化率将________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,向100mL
时,向100mL![]()
![]() 溶液中滴加
溶液中滴加![]() NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图
NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图![]() 视为二元强酸)。下列说法错误的是 ( )
视为二元强酸)。下列说法错误的是 ( )

A.a点时溶液的![]()
B.c点时离子浓度大小顺序为:![]()
C.de段上的点均满足关系式:![]()
D.a点到b点的过程中,溶液的导电能力增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH为2的氢氟酸稀释100倍后,pH<4。则250C时,将0.1mol·L-1的HF加水不断稀释,下列表示的量保持不变的是( )
①n(H+); ②c(H+)·c(OH—);③c(OH—)+ c(F—);④![]() ⑤
⑤![]() ;
;
A.①③④B.②③④C.③④⑤D.②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知N2(g)+3H2(g)![]() 2NH3(g) △H=-92.3kJ/mol,在一定温度和催化剂的条件下,向一密闭容器中,通入1molN2和3molH2,达到平衡状态I;相同条件下,向另一体积相同的密闭容器中通入0.9molN2、2.7molH2和0.2molNH3,达到平衡状态II,则下列说法正确的是
2NH3(g) △H=-92.3kJ/mol,在一定温度和催化剂的条件下,向一密闭容器中,通入1molN2和3molH2,达到平衡状态I;相同条件下,向另一体积相同的密闭容器中通入0.9molN2、2.7molH2和0.2molNH3,达到平衡状态II,则下列说法正确的是
A.两个平衡状态的平衡常数的关系:KⅠ<KⅡ
B.H2的百分含量相同
C.N2的转化率:平衡I<平衡Ⅱ
D.反应放出的热量:QⅠ=QⅡ<92.3kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬及其化合物具有广泛应用。请回答下列问题:
(1)![]() 与
与![]() 的化学性质相似。向
的化学性质相似。向![]() 溶液中加入过量NaOH溶液,反应的离子方程式为______;加热
溶液中加入过量NaOH溶液,反应的离子方程式为______;加热![]() 溶液,灼烧固体,所得固体的成分是______。
溶液,灼烧固体,所得固体的成分是______。
(2)![]() 和
和![]() 在溶液中可相互转化
在溶液中可相互转化![]() 室温下,初始浓度为
室温下,初始浓度为![]() 的
的![]() 溶液中
溶液中![]() 随
随![]() 的变化如图所示。
的变化如图所示。
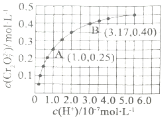
①下列可判断反应达平衡状态的是______![]() 填标号
填标号![]() 。
。
A.溶液的pH不再变化
B.![]()
C.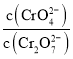 为定值
为定值
②A点![]() 点的逆反应速率大小为
点的逆反应速率大小为![]() 逆
逆![]() ______
______![]() 逆
逆![]() 填:“
填:“![]() ”、“=”或“
”、“=”或“![]() ”
”![]() 。
。
③由图得出,溶液酸性增强,![]() 的平衡转化率______
的平衡转化率______![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() ;
;![]() 时,该反应的平衡常数为______。
时,该反应的平衡常数为______。
(3)化学分析中采用![]() 为指示剂,以
为指示剂,以![]() 标准溶液滴定溶液中的
标准溶液滴定溶液中的![]() ,利用
,利用![]() 与
与![]() 生成砖红色沉淀,指示到达滴定终点。硝酸银标准液应盛放在______
生成砖红色沉淀,指示到达滴定终点。硝酸银标准液应盛放在______![]() 填:“酸式”、“碱式”
填:“酸式”、“碱式”![]() 滴定管中。
滴定管中。
(4)常温下,铬酸![]() ,
,![]() ,
,![]() 溶液中离子浓度由大到小的顺序为______。
溶液中离子浓度由大到小的顺序为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com