
【题目】铬及其化合物具有广泛应用。请回答下列问题:
(1)![]() 与
与![]() 的化学性质相似。向
的化学性质相似。向![]() 溶液中加入过量NaOH溶液,反应的离子方程式为______;加热
溶液中加入过量NaOH溶液,反应的离子方程式为______;加热![]() 溶液,灼烧固体,所得固体的成分是______。
溶液,灼烧固体,所得固体的成分是______。
(2)![]() 和
和![]() 在溶液中可相互转化
在溶液中可相互转化![]() 室温下,初始浓度为
室温下,初始浓度为![]() 的
的![]() 溶液中
溶液中![]() 随
随![]() 的变化如图所示。
的变化如图所示。
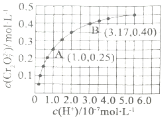
①下列可判断反应达平衡状态的是______![]() 填标号
填标号![]() 。
。
A.溶液的pH不再变化
B.![]()
C.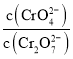 为定值
为定值
②A点![]() 点的逆反应速率大小为
点的逆反应速率大小为![]() 逆
逆![]() ______
______![]() 逆
逆![]() 填:“
填:“![]() ”、“=”或“
”、“=”或“![]() ”
”![]() 。
。
③由图得出,溶液酸性增强,![]() 的平衡转化率______
的平衡转化率______![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() ;
;![]() 时,该反应的平衡常数为______。
时,该反应的平衡常数为______。
(3)化学分析中采用![]() 为指示剂,以
为指示剂,以![]() 标准溶液滴定溶液中的
标准溶液滴定溶液中的![]() ,利用
,利用![]() 与
与![]() 生成砖红色沉淀,指示到达滴定终点。硝酸银标准液应盛放在______
生成砖红色沉淀,指示到达滴定终点。硝酸银标准液应盛放在______![]() 填:“酸式”、“碱式”
填:“酸式”、“碱式”![]() 滴定管中。
滴定管中。
(4)常温下,铬酸![]() ,
,![]() ,
,![]() 溶液中离子浓度由大到小的顺序为______。
溶液中离子浓度由大到小的顺序为______。
【答案】![]()
![]()
![]() < 增大
< 增大 ![]() 酸式
酸式 ![]()
【解析】
(1)Cr3+与Al3+的化学性质相似可知Cr2(SO4)3溶液中逐滴加入NaOH溶液,先生成Cr(OH)3灰蓝色沉淀,继续加入NaOH后沉淀溶解,生成绿色的Cr(OH)4,反应的离子方程式为:Cr3++4OH=[Cr(OH)4],加热CrCl3溶液,促进水解生成氢氧化铬,灼烧固体氢氧化铬生成Cr2O3;
(2)①CrO42和Cr2O72在溶液中可相互转化2CrO42+2H+![]() Cr2O72+H2O,平衡标志是正逆反应速率相同,各组分含量保持不变,
Cr2O72+H2O,平衡标志是正逆反应速率相同,各组分含量保持不变,
A.溶液的pH不再变化说明氢离子浓度不变,反应达到平衡状态,故A正确;
B.速率之比等于化学方程式计量数之比,v(H+)=2v(Cr2O72)不能说明正逆反应速率相同,不能说明反应达到平衡状态,故B错误;
C.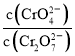 为定值说明其物质的量不变,反应达到平衡状态,故C正确;
为定值说明其物质的量不变,反应达到平衡状态,故C正确;
答案选AC。
②A点B点氢离子浓度增大平衡正向进行,逆反应速率增大,反应的逆反应速率大小为vA(逆)<vB(逆)。
③由图得出,溶液酸性增强,K2CrO4的平衡转化率增大,结合A点计算平衡常数。A点Cr2O72的浓度为0.25mol/L,则消耗的CrO42的浓度为0.5mol/L,则溶液中的c(CrO42)=1.0mol/L-0.25mol/L×2=0.5mol/L,c(H+)=1×107mol/L,此时该转化反应的平衡常数为K=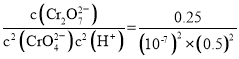 =1.0×1014;
=1.0×1014;
(3)硝酸银溶液为强酸弱碱盐,银离子水解溶液显酸性,硝酸银标准液应盛放在酸式滴定管中;
(4)常温下,铬酸(H2CrO4)Ka1=4.1,Ka2=105.9,KHCrO4溶液中铬酸氢根的水解常数Kh= =
=![]() =2.4×1014<Ka2,所以铬酸氢根的电离程度大于水解程度,溶液显酸性,所以离子浓度由大到小的顺序为
=2.4×1014<Ka2,所以铬酸氢根的电离程度大于水解程度,溶液显酸性,所以离子浓度由大到小的顺序为![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】过渡态理论认为:化学反应并不是通过简单的碰撞就能完成的,而是从反应物到生成物的过程中经过一个高能量的过渡态。如图1为1molNO2与1molCO恰好反应生成CO2和NO过程中的能量变化示意图

(1)试写出NO2和CO反应的热化学方程式:________
(2)在密闭容器中进行的上述反应是可逆反应,图2是某学生模仿图1画出的NO+CO2 =NO2+CO的能量变化示意图。则图中E3=________kJmol-1
(3)在密闭容器中充入1molH2和1molI2 , 压强为p(Pa),并在一定温度下使其发生反应:H2(g)+I2(g)2HI(g)△H<0.保持容器内气体压强不变,向其中加入1molN2 , 反应速率________(填“变大”、“变小”或“不变”),平衡________移动(填“向正反应方向”、“向逆反应方向”或“不”)。
(4)T℃,向1L密闭容器中加入1molHI(g),发生反应2HIH2+I2, H2物质的量随时间的变化如图3所示。
①该温度下,2HI(g)H2(g)+I2(g)的平衡常数K=________
②相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则________是原来的2倍。
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量的浓度和混合液的pH如下表所示:
实验编号 | HA的物质的量浓度(mol·L-1) | NaOH的物质的量浓度(mol·L-1) | 混合后溶液的pH |
甲 | 0.1 | 0.1 | pH=a |
乙 | 0.12 | 0.1 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还弱酸? 。
(2)乙组混合溶液中离子浓度c(A-)和c(Na+)的大小关系是 。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是 。
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)= mol/L。
Ⅱ.某二元酸(分子式用H2B表示)在水中的电离方程式是:H2B=H++HB-;HB-![]() H++B2-
H++B2-
回答下列问题:
(5)在0.1 mol/L的Na2B溶液中,下列粒子浓度关系式正确的是 。
A.c(B2-)+c(HB-)=0.1mol/L
B.c(B2-)+c(HB-)+c(H2B)=0.1mol/L
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制适当的条件,将反应2Fe3++2I-![]() 2Fe2++I2设计成如图所示的原电池,下列判断错误的是
2Fe2++I2设计成如图所示的原电池,下列判断错误的是
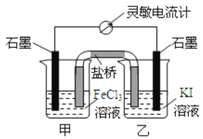
A. 反应开始时,乙中电极反应为2I--2e-=I2
B. 反应开始时,甲中石墨电极上发生还原反应
C. 电流计读数为零时,反应达到化学平衡状态
D. 平衡时乙中溶入碘后,甲池的石墨电极为正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向100mL 1molL﹣1H2SO3溶液中逐渐滴入1molL﹣1的NaOH溶液,含硫物质的分布分数δ(平衡时某物质的浓度与各物质浓度之和的比)与pH的关系如图所示(已知:pKs=﹣lgK,25℃时,H2SO3的pKa1=1.85,pKa2=7.19).下列说法不正确的是( )
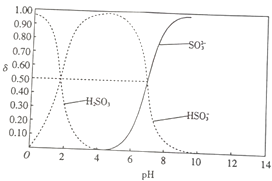
A.pH=1.85时,c(H2SO3)=c(HSO3﹣)
B.pH=6时,c(Na+)>c(HSO3﹣)>c(SO32﹣)
C.pH=7.19时,c(Na+)+c(H+)=c(HSO3﹣)+2c(SO3﹣)+c(OH﹣)
D.加入150mLNaOH溶液时,3c(Na+)=2c(H2SO3)+2c(HSO3﹣)+2c(SO32﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将0.1000mol·L-1的AgNO3标准溶液分别滴加到20mL浓度均为0.1000mol·L-1的NaCl和NaBr溶液中,混合溶液的pAg [-lgc(Ag+)]与滴定百分数(滴定所用标准溶液体积相对于滴定终点时所用标准溶液体积的百分数)的变化关系如图所示。下列叙述错误的是
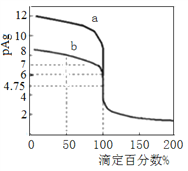
A. 曲线a代表滴定NaBr溶液
B. Ksp(AgCl) =1×10-9.5
C. 滴定至50%时,NaCl溶液中c(Na+) >c(NO3-)>c(Ag+)>c(H+)
D. 滴定至100%时,c(H+) +c(Ag+) = c(Br-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列图像的描述不正确的是

A. 图①可以表示在绝热容器中放入N2和H2,在催化合成氨的过程中,N2的转化率随时间的变化曲线
B. 图②可以表示在T℃的密闭容器中,反应2AgBr(s)![]() 2Ag(s)+Br2(g)达到平衡,此时再开始增大容器的体积,最终容器中仍有AgBr(s)剩余时容器内压强的变化曲线
2Ag(s)+Br2(g)达到平衡,此时再开始增大容器的体积,最终容器中仍有AgBr(s)剩余时容器内压强的变化曲线
C. 图③可以表示等体积等pH的碳酸钠溶液和醋酸钠溶液加水稀释过程中pH的变化趋势
D. 图④可以表示氯化银和溴化银饱和溶液等体积混合后,再向该混合溶液中加入浓AgNO3溶液时,生成沉淀的物质的量随加入AgNO3溶液体积的变化曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能应用化学平衡移动原理来解释的是
①可用浓氨水和NaOH固体快速制氨气 ②700K左右比室温更有利于合成氨反应
③开启啤酒瓶后,瓶中马上泛起大量泡沫 ④温度升高水的KW增大
⑤对于反应2HI(g) ![]() H2(g)+I2(g)达平衡后,缩小容器体积可使体系颜色变深
H2(g)+I2(g)达平衡后,缩小容器体积可使体系颜色变深
A. ①②③ B. ②④⑤ C. ②⑤ D. ④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验:①0.1mol·L-1AgNO3溶液和0.1mol·L-1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;② 向滤液b中滴加0.1mol·L-1KI溶液,出现浑浊;③ 向沉淀c中滴加0.1mol·L-1KI溶液,沉淀变为黄色。下列分析不正确的是
A.浊液a中存在沉淀溶解平衡:AgCl(s)![]() Ag+(aq)+ Cl-(aq)
Ag+(aq)+ Cl-(aq)
B.滤液b中不含有Ag+
C.③中颜色变化说明AgCl 转化为AgI
D.实验可以证明AgI比AgCI更难溶
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com