
【题目】![]() 时,向100mL
时,向100mL![]()
![]() 溶液中滴加
溶液中滴加![]() NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图
NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图![]() 视为二元强酸)。下列说法错误的是 ( )
视为二元强酸)。下列说法错误的是 ( )

A.a点时溶液的![]()
B.c点时离子浓度大小顺序为:![]()
C.de段上的点均满足关系式:![]()
D.a点到b点的过程中,溶液的导电能力增强
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:

已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是
A. 550℃时,若充入惰性气体,正,逆 均减小,平衡不移动
B. 650℃时,反应达平衡后CO2的转化率为25.0%
C. T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D. 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行下列实验,不能得出相应实验结论的是

选项 | ① | ② | ③ | 实验结论 |
A | 稀硫酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:S>C>Si |
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 |
C | 浓硝酸 | Fe | NaOH溶液 | 说明铁和浓硝酸反应可生成NO2 |
D | 浓氨水 | 生石灰 | 酚酞 | 氨气的水溶液呈碱性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现需设计一套实验装置来电解饱和食盐水,并测量电解产生的氢气的体积(约6 mL)和检验氯气的氧化性(不应将多余的氯气排入空气中)。
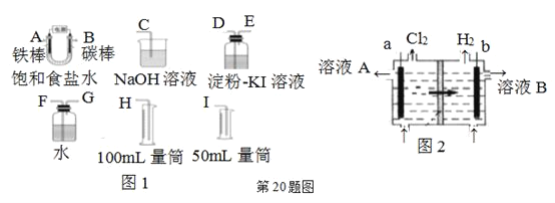
(1)试从上图图1中选用几种必要的仪器,连成一整套装置,各种仪器接口的连接顺序(填编号)是:A接________,B接________。
(2)铁棒接直流电源的________极;碳棒上发生的电极反应为________。
(3)能说明氯气具有氧化性的实验现象是________。
(4)假定装入的饱和食盐水为50 mL(电解前后溶液体积变化可忽略),当测得的氢气为5.6 mL(已折算成标准状况)时,溶液的pH为________。
(5)工业上采用离子交换膜法电解饱和食盐水,如上图图2,该离子交换膜是________(填“阳离子”或“阴离子”)交换膜,溶液A是________(填溶质的化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡态理论认为:化学反应并不是通过简单的碰撞就能完成的,而是从反应物到生成物的过程中经过一个高能量的过渡态。如图1为1molNO2与1molCO恰好反应生成CO2和NO过程中的能量变化示意图

(1)试写出NO2和CO反应的热化学方程式:________
(2)在密闭容器中进行的上述反应是可逆反应,图2是某学生模仿图1画出的NO+CO2 =NO2+CO的能量变化示意图。则图中E3=________kJmol-1
(3)在密闭容器中充入1molH2和1molI2 , 压强为p(Pa),并在一定温度下使其发生反应:H2(g)+I2(g)2HI(g)△H<0.保持容器内气体压强不变,向其中加入1molN2 , 反应速率________(填“变大”、“变小”或“不变”),平衡________移动(填“向正反应方向”、“向逆反应方向”或“不”)。
(4)T℃,向1L密闭容器中加入1molHI(g),发生反应2HIH2+I2, H2物质的量随时间的变化如图3所示。
①该温度下,2HI(g)H2(g)+I2(g)的平衡常数K=________
②相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则________是原来的2倍。
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知电导率越大导电能力越强。常温下用0.100 mol·L-1NaOH溶液分别滴定10.00mL浓度均为0.100 mol·L-1的盐酸和醋酸溶液,测得滴定过程中溶液的电导率如图所示。下列说法正确的是

A. 曲线①代表滴定盐酸的曲线
B. 滴定醋酸的过程应该选择甲基橙作为指示剂
C. a、b、c三点溶液中水的电离程度:c>a>b
D. b点溶液中:c(OH-)>c(H+)+c(CH3COO-)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.2mol/L一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是

A. HA是强酸
B. 该混合液pH=7
C. 图中x表示HA,Y表示OH-,Z表示H+
D. 该混合溶液中:c(A-)+c(Y)=c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绝热容器中发生反应:3Z(s)![]() X(g)+2Y(g)△H=a kJ·mol-1(a>0)。下列说法不正确的是
X(g)+2Y(g)△H=a kJ·mol-1(a>0)。下列说法不正确的是
A.将0.3 mol Z置于容器中充分反应生成气体的物质的量一定小于0.3 mol
B.达到化学平衡状态时,气体平均摩尔质量不变
C.容器中放入3mol Z,达到化学平衡状态时,反应吸收的总热量为a kJ
D.容器温度不变,反应已经达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将0.1000mol·L-1的AgNO3标准溶液分别滴加到20mL浓度均为0.1000mol·L-1的NaCl和NaBr溶液中,混合溶液的pAg [-lgc(Ag+)]与滴定百分数(滴定所用标准溶液体积相对于滴定终点时所用标准溶液体积的百分数)的变化关系如图所示。下列叙述错误的是
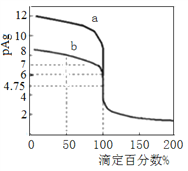
A. 曲线a代表滴定NaBr溶液
B. Ksp(AgCl) =1×10-9.5
C. 滴定至50%时,NaCl溶液中c(Na+) >c(NO3-)>c(Ag+)>c(H+)
D. 滴定至100%时,c(H+) +c(Ag+) = c(Br-)+c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com