
【题目】利用如图所示装置进行下列实验,不能得出相应实验结论的是

选项 | ① | ② | ③ | 实验结论 |
A | 稀硫酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:S>C>Si |
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 |
C | 浓硝酸 | Fe | NaOH溶液 | 说明铁和浓硝酸反应可生成NO2 |
D | 浓氨水 | 生石灰 | 酚酞 | 氨气的水溶液呈碱性 |
A.AB.BC.CD.D
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠![]() 又称保险粉,是印刷工业中重要的还原剂。某课题小组进行如下实验。
又称保险粉,是印刷工业中重要的还原剂。某课题小组进行如下实验。
Ⅰ.查阅材料
i.连二亚硫酸钠![]() 是一种白色粉末,易溶于水,难溶于乙醇。
是一种白色粉末,易溶于水,难溶于乙醇。
ii.![]()
iii.![]()
II.制备方法
![]() ℃时将甲酸钠和纯碱加入乙醇水溶液中,通入
℃时将甲酸钠和纯碱加入乙醇水溶液中,通入![]() 进行反应,完成其反应方程式:_____
进行反应,完成其反应方程式:_____![]() ______
______ ![]() ______ = ______
______ = ______ ![]() ______
______ ![]() ____,冷却至40℃~45℃,过滤,用 ______ 洗涤,干燥制得
____,冷却至40℃~45℃,过滤,用 ______ 洗涤,干燥制得![]() ;
;
III.![]() 的性质
的性质
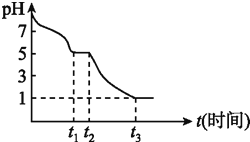
(1)![]() 溶液在空气中易被氧化,课题小组测定
溶液在空气中易被氧化,课题小组测定![]()
![]()
![]() 溶液在空气中pH变化如图:
溶液在空气中pH变化如图:![]() 段主要生成
段主要生成![]() ,根据pH变化图,
,根据pH变化图,![]() 的电离平衡 ______ 水解平衡
的电离平衡 ______ 水解平衡![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() ,课题小组推测
,课题小组推测![]() 溶液在空气中易被氧化,
溶液在空气中易被氧化,![]() 发生离子反应方程式为 ______
发生离子反应方程式为 ______ ![]() 时溶液中主要阴离子符号是 ______ 。
时溶液中主要阴离子符号是 ______ 。
(2)隔绝空气加热![]() 固体完全分解得到固体产物
固体完全分解得到固体产物![]() 、
、![]() 和气体为 ______
和气体为 ______ ![]() 填化学式
填化学式![]() 请你设计实验验证产物有
请你设计实验验证产物有![]() 存在,完成下表中内容.
存在,完成下表中内容.![]() 供选择的试剂:稀盐酸、稀硝酸、
供选择的试剂:稀盐酸、稀硝酸、![]() 溶液、
溶液、![]() 溶液
溶液![]()
实验步骤 | 预期的实验现象和结论 |
________ | ________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳族、氮族元素及其化合物在生产、生活和环境保护中应用广泛。
(1)下列有关物质性质递变的描述中,正确的是________________(填代号)。
A.酸性:HNO3>H2CO3>H2SiO3 B.稳定性:NH3>AsH3>PH3
C.稳定性:N2<P4(白磷) D.常温下,同浓度溶液的pH:Na3PO4<Na3AsO4
(2)已知:
(a)CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3 kJ·mol1
(b)2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ·mol1
(c)C(s)+O2(g)=CO2(g) ΔH3=-393.5 kJ·mol1
①C(s)+2H2(g)=CH4(g) ΔH=___________kJ·mol1。
②CH4制备合成气的原理是CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
A. 下列叙述不能表示该反应在恒温恒容条件下达到平衡状态的是____。
a. 混合气体的压强不再发生变化
b. 混合气体的密度不再发生变化
c. 反应容器中CO2、CO的物质的量的比值不再发生变化
d. 混合气体的平均相对分子质量不再发生变化
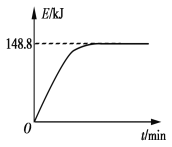
B. 若1 g CH4(g)完全反应吸收热量为15.5 kJ。在恒容密闭容器中充入1 mol CH4和1 mol CO2在一定条件下反应,体系吸收热量随着时间变化如图所示。在该条件下,甲烷的最大转化率(α)为____________。
(3)在密闭容器中发生反应:2NO(g)+H2(g)= N2(g)+2H2O(g),其反应速率与浓度关系式为v=kcm(NO)·cn(H2)(k为常数,只与温度有关,m、n为反应级数,取正整数),在某温度下测得有关数据如表所示。
序数 | c(NO)/(mol·L1) | c(H2)/(mol·L1) | v/(mol·L1·min1) |
Ⅰ | 0.10 | 0.10 | 0.414 |
Ⅱ | 0.20 | 0.20 | 3.312 |
Ⅲ | 0.10 | 0.20 | 0.828 |
总反应分两步进行:第i步,2NO+H2=N2+H2O2(很慢);第ii步,H2O2+H2![]() 2H2O(很快)。在上述温度下,当c(NO)=c(H2)=0.50 mol·L1时v=_________mol·L1·min1。
2H2O(很快)。在上述温度下,当c(NO)=c(H2)=0.50 mol·L1时v=_________mol·L1·min1。
(4)在2 L恒容密闭容器中充入3 mol NO(g)和3 mol CO(g),发生反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g),在一定温度下达到平衡,测得平衡体系中c(N2)=0.5 mol·L1。则该条件下平衡常数K值为_______。反应前后容器内气体压强之比为_________________________。
N2(g)+2CO2(g),在一定温度下达到平衡,测得平衡体系中c(N2)=0.5 mol·L1。则该条件下平衡常数K值为_______。反应前后容器内气体压强之比为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验设计能够成功的是( )
A.检验亚硫酸钠试样是否变质
试样![]() 白色沉淀
白色沉淀![]() 沉淀不溶解→说明试样已变质
沉淀不溶解→说明试样已变质
B.除去粗盐中含有的硫酸钙杂质
粗盐![]()
![]()
![]() 精盐
精盐
C.检验某溶液中是否含有Fe2+
试样![]() 溶液颜色无变化
溶液颜色无变化![]() 溶液变红色→溶液中含有Fe2+
溶液变红色→溶液中含有Fe2+
D.证明酸性条件H2O2的氧化性比I2强
NaI溶液![]() 溶液变紫色→氧化性:H2O2>I2
溶液变紫色→氧化性:H2O2>I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(气)+B(气)![]() 2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7 mol·L-1
其中正确的是:
A.①③B.①④C.②③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图所示。下列说法不正确的是( )

A.盐酸的浓度越大,腐蚀速率越快
B.碳素钢的腐蚀速率不随硫酸的浓度增大而增大,说明反应速率不与c(H+)成正比
C.钼酸钠和月桂酰肌氨酸的浓度相等时,腐蚀速率最小
D.对比盐酸和硫酸两条曲线,可知Cl-也可能会影响碳素钢的腐蚀速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见的某反应的化学方程式为a+b→c+d+H2O(未配平,条件略去)。下列叙述不正确的是( )
A. 若a是铁,b是稀硝酸(过量),且a可溶于c溶液中。则a与b反应的离子方程式为 Fe+4H++NO3-=Fe3++NO↑+2H2O
B. 若c,d均为气体,且都能使澄清石灰水变浑浊,则将混合气体通入溴水中,橙色褪去,其褪色过程的离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br-
C. 若c是无色刺激性气味的气体,其水溶液呈弱碱性。在标准状况下用排空气法收集c气体得平均摩尔质量为20g·mo1-1的混合气体进行喷泉实验。假设溶质不扩散,试验完成后所得溶液的物质的量浓度约为0.056mo1·L-1
D. 若a是造成温室效应的主要气体之一,c、d均为钠盐,参加反应的a、b物质的量之比为4:5,则上述反应的离子方程式为4CO2+5OH-=CO32+3HCO3-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,向100mL
时,向100mL![]()
![]() 溶液中滴加
溶液中滴加![]() NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图
NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图![]() 视为二元强酸)。下列说法错误的是 ( )
视为二元强酸)。下列说法错误的是 ( )

A.a点时溶液的![]()
B.c点时离子浓度大小顺序为:![]()
C.de段上的点均满足关系式:![]()
D.a点到b点的过程中,溶液的导电能力增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在一容积不变的密闭容器中发生的可逆反应2X(g)![]() Y(g)+Z(s),下列选项不能作为反应达到平衡标志的是
Y(g)+Z(s),下列选项不能作为反应达到平衡标志的是
A. 反应容器中压强不再变化 B. 混合气体的密度不再变化
C. 混合气体的平均相对分子质量不再变化 D. Z的浓度不再改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com