
【题目】常温下,向20mL某浓度的硫酸溶液中滴入0.1mol/L氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图。下列分析正确的是( )
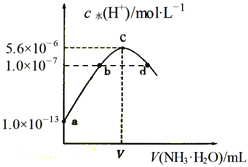
A. V=40
B. c点所示溶液中:c(H+ )-c(OH-)=2c(NH3·H2O)
C. NH3·H2O的电离常数K=10-4
D. d点所示溶液中:c(NH4+)=2c(SO42-)
【答案】D
【解析】试题分析:A、c点水电离程度最大,盐类水解促进水的电离,说明此时c(NH4+)最大,对水的电离促进程度最大,所以两者恰好完全反应生成硫酸铵,氨水体积为0时,水电离出氢离子的浓度为1×10-13mol·L-1,则水电离出的c(OH-)的浓度为1×10-13mol·L-1,溶液中中氢离子的浓度为0.1mol·L-1,稀硫酸的浓度为0.05mol·L-1,所以氨水的体积也是20ml,即V=20,故错误;B、c点所示溶液是硫酸铵溶液,质子守恒得:c(H+)-c(OH-)═c(NH3·H2O),故错误;C、根据题意,无法判断NH3·H2O的电离常数的大小,故错误;D、根据电荷守恒:c(H+)+c(NH4+)═2c(SO42-)+c(OH-),而溶液呈中性c(OH-)═c(H+),所以c(NH4+)═2c(SO42-),故正确。


科目:高中化学 来源: 题型:
【题目】能使H2O+H2O![]() H3O++OH-电离平衡向正反应方向移动,且所得溶液呈酸性的是
H3O++OH-电离平衡向正反应方向移动,且所得溶液呈酸性的是
A.在水中加Na2CO3固体B.在水中加入CuCl2固体
C.在水中加入稀硫酸D.将水加热到99℃,其中c(H+)=1×10-6mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.含氨废水和废气对环境造成的污染越来越严重,某课外活动小组先测定废水中含NO3-为3×10-4 mol/L,而后用金属铝将NO3-还原为N2,从而消除污染。
(1)配平下列有关离子方程式:_____NO3-+_______Al+_______H2O→_______N2↑+______Al(OH)3+________OH-。
(2)上述反应中被还原的元素是____________,每生成2 molN2转移_________mol电子。
(3)有上述废水100 m3,若要完全消除污染,则所消耗金属铝的质量为_________g。
Ⅱ.NO与Cl2在常温常压下可以合成亚硝酰氯(NOCl)。它是一种红褐色液体或黄色气体,其熔点-64.5 ℃,沸点-5.5℃,遇水易水解。亚硝酰氯(NOCl)是有机合成中的重要试剂。实验室制备原料气Cl2的装置如图所示:
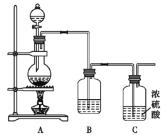
(4)实验室制Cl2时,装置A中烧瓶内发生反应的化学方程式为_________________________。
(5)将上述收集到的Cl2充入D的集气瓶中,按图示装置制备亚硝酰氯。
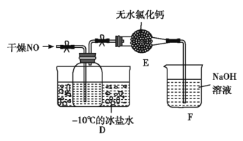
①装置D中发生的反应方程式为__________________________。
②如果不用装置E会引起什么后果:__________________。
③某同学认为装置F不能有效吸收尾气中的某种气体,该气体为_____________,为了充分吸收尾气,可将尾气与________________同时通入氢氧化钠溶液中。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25mL 0.1mol·L-1NaOH溶液中逐滴加入0.2mol·L-1CH3COOH溶液,溶液pH变化曲线如图所示,下列有关离子浓度的比较正确的是

A.在A、B间任一点(不含A、B点),溶液中可能有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点,c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.在D点,c(CH3COO-)+c(CH3COOH)=c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸式盐NaHB在水溶液中,HB﹣的电离程度小于HB﹣的水解程度,下列说法正确的是( )
A.NaHB的存在抑制了水的电离
B.HB﹣水解方程式:HB﹣+H2O![]() H3O++B2﹣
H3O++B2﹣
C.相同物质的量浓度溶液的pH值:NaHB>Na2B
D.溶液中离子浓度大小为:c(Na+)>c(HB﹣)>c(OH﹣)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素原子的核电荷数依次增大![]() 均小于
均小于![]() ,其单质及相应的化合物能发生如下反应关系:
,其单质及相应的化合物能发生如下反应关系:
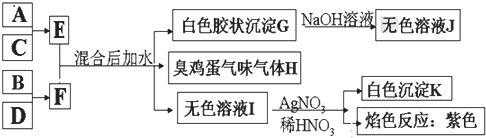
(1)写出F的电子式 ______ 。
(2)气体H有毒,可用![]() 溶液吸收,生成两种酸式盐,该反应的化学方程式为: ______ 。
溶液吸收,生成两种酸式盐,该反应的化学方程式为: ______ 。
(3)加热E的水溶液后并灼烧,最终得到的固体为 ______ ,原因为 ______ 、 ______ ![]() 用化学反应方程式来表示
用化学反应方程式来表示![]() 。
。
(4)室温下,向F的水溶液中加入等体积等浓度的盐酸反应后所得溶液的![]() ,则此溶液中离子浓度由小到大的顺序为: ______ 。
,则此溶液中离子浓度由小到大的顺序为: ______ 。
(5)将气体H放在空气中充分燃烧可得到气体氧化物![]() ,
,![]() 可与氧气继续反应:
可与氧气继续反应:![]() ,在一个固定容积为2L的密闭容器中充入
,在一个固定容积为2L的密闭容器中充入![]() 的
的![]() 和
和![]() 的
的![]() ,半分钟后达到平衡,测得容器中含
,半分钟后达到平衡,测得容器中含![]() 为0.18mol,则υ(O2)=______ mol/(L·min),若继续通入
为0.18mol,则υ(O2)=______ mol/(L·min),若继续通入![]()
![]() 和
和![]()
![]() ,再次达到新平衡后,
,再次达到新平衡后,![]() 的物质的量介于 ______ 之间。
的物质的量介于 ______ 之间。
(6)写出E和F反应的化学反应方程式: ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,下列反应不可能自发进行的是
A.2O3(g)=3O2(g) △H<0
B.CaCO3(s)=CaO(s)+CO2(g) △H>0
C.N2(g)+3H2(g) ![]() 2NH3(g) △H<0
2NH3(g) △H<0
D.2CO(g)=2C(s)+O2(g) △H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法可以证明反应![]()
![]() 已达到平衡状态的是
已达到平衡状态的是![]()
A.1个![]() 分解的同时,有3个
分解的同时,有3个![]() 的形成
的形成
B.1个![]() 分解的同时,有3个
分解的同时,有3个![]() 的分解
的分解
C.1个![]() 分解的同时,有1个
分解的同时,有1个![]() 的分解
的分解
D.1个![]() 分解的同时,有2个
分解的同时,有2个![]() 的形成
的形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述与盐类水解无关的是( )
A.饱和食盐水使甲基橙显黄色
B.FeCl3溶液加热蒸干得到Fe2O3
C.NH4Cl溶液除铁锈
D.Na2CO3等盐溶液不能盛装在玻璃塞的试剂瓶中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com