
【题目】某兴趣小组进行铁矿石中含铁量的测定,实验过程如图:
![]()
下列说法正确的是( )
A.加热煮沸的主要目的是除去溶液中溶解的氧气
B.稀释过程中用到的玻璃仪器主要有烧杯、玻璃棒、胶头滴管
C.滴定过程中可用淀粉溶液作指示剂
D.铁矿石中铁的质量分数为70%
科目:高中化学 来源: 题型:
【题目】喷泉是一种常见的自然现象,其产生原因是存在压强差。
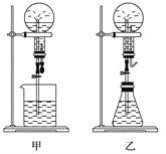
(1)图甲中,为化学教学中所用的喷泉实验装置。在烧瓶中充满干燥气体,胶头滴管及烧杯中盛有液体。
①下列组合中不可能形成喷泉的是(______)。
A.HCl和H2O B.O2和H2O C.NH3和H2O D.CO2和NaOH溶液 E.NO2和H2O
②若用D组合做喷泉实验,烧杯中的液体一定是NaOH溶液吗________?
③用A组合做喷泉实验时,若烧瓶中充满HCl气体,则在标准状况下,做完实验后烧瓶中c(HCl)=________mol·L-1(设溶质不扩散)。
④若用E组合做喷泉实验时,则标准状况下,做完实验后烧瓶中溶质的物质的量浓度是________mol·L-1。
(2)某学生积极思考产生喷泉的其他办法,并设计了如图乙所示的装置。
①在图乙的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是(______)
A.Cu与稀盐酸 B.NaHCO3与NaOH溶液
C.CaCO3与稀硫酸 D.NH4HCO3与稀盐酸
这种方法产生喷泉的原理是__________________。
②在图乙锥形瓶外放一水槽,瓶中加入酒精,水槽中加入水后,再加入足量的下列物质,结果也产生喷泉。水槽中加入的物质可以是________这种方法产生喷泉的原理是_____________________________________________________。
A.浓硫酸 B.食盐 C.硝酸钾 D.硫酸铜
③比较图甲和图乙两套装置,从产生喷泉的原理来分析,图甲________上部烧瓶内气体压强;图乙________下部锥形瓶内气体压强(填“增大”或“减小”)。
(3)城市中常见的人造喷泉及火山爆发的原理与上述________(填“图甲”或“图乙”)装置的原理相似。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的液化可以合成甲醇。下列有关说法正确的是
①“气化”:C(s)+2H2O(g)===CO2(g)+2H2(g)ΔH1=+90.1kJ·mol—1
②催化液化I:CO2(g)+3H2(g)===CH3OH(g)+H2O(g)△H2=-49.0kJ·mol—1
③催化液化Ⅱ:CO2(g)+2H2(g)===CH3OH(g)+![]() O2(g)△H3=akJ·mol
O2(g)△H3=akJ·mol
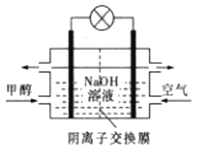
A. 催化液化I的反应在高温下更容易自发进行
B. C(s)+H2O(g)+H2(g)==CH3OH(g)△H=+41.1kJ·mol—1
C. △H2>△H3
D. 如图所示为甲醇燃料电池的工作原理示意图,负极的电极反应为CH3OH-6e—+6OH—=CO2↑+5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、恒容的密闭容器中进行反应 A(g)═B(g)+C(g),若反应物的浓度由2molL-1 降到 0.8molL-1 需要 20s,那么反应物浓度再由 0.8molL-1 降到 0.2molL-1 所需要的时间为
A.10sB.大于 10sC.小于 10sD.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】mA(g)+nB(g)![]() pC(g)的速率和平衡的影响图像如下,下列判断正确的是
pC(g)的速率和平衡的影响图像如下,下列判断正确的是
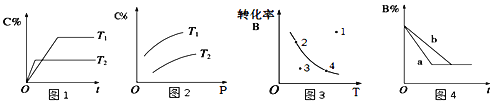
A.由图1可知,T1<T2,该反应正反应为吸热反应
B.由图2可知,该反应m+n﹤p
C.图3中,表示反应速率v正>v逆的是点3
D.图4中,若m+n=p,则a曲线一定使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D 均是短周期元素,A 和 B 同周期, B 和 C 同族,A 元素族序数是周期数的三倍,B 原子最外层电子数是内层电子数的二倍,B 与 A 能生成化合物 BA2,C 与 A 生 成化合物 CA2, A 的阴离子与 D 的阳离子电子层结构相同,都与氖原子的电子层结构相同, D 的单质与 A 的单质在不同条件下反应,可生成 D2A 或 D2A2。请回答
(1)写出元素符号 B:_____C:_____
(2)D2A2 的化学式_____.
(3)BA2 的电子式_____,BA2 分子中化学键属于_____键。
(4)C 在元素周期表中的位置是第_____周期_____族,其原子结构示意图为______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制乙烯时,常因温度过高而发生副反应,使部分乙醇跟浓硫酸反应生成二氧化硫、二氧化碳、水蒸气和炭黑。
(1)写出实验室制取乙烯的化学方程式______________________________
编号 | ① | ② | ③ | ④ |
装置 |
|
|
|
|
(2)请用表中编号为①、②、③、④的装置设计一个实验,以验证上述反应混合气体中含CO2、SO2和水蒸气.用装置的编号表示装置的连接顺序(按产物气流从左到右顺序): ___________________________.
(3)实验时装置①中A瓶的现象是________,B瓶溶液的作用是____________。B中的溴水能否用酸性KMnO4溶液代替,为什么?____________________。
(4)装置③中加的固体药品是________,以验证混合气体中有_____________。装置②中盛的溶液是______________,以验证混合气体中的_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MgCO3和CaCO3的能量关系如图所示(M=Ca、Mg):
M2+(g)+CO32-(g) ![]() M2+(g)+O2(g)+CO2(g)
M2+(g)+O2(g)+CO2(g)
![]()
![]()
![]()
已知:离子电荷相同时,半径越小,离子键越强。下列说法不正确的是
A. ΔH1(MgCO3)>ΔH1(CaCO3)>0
B. ΔH2(MgCO3)=ΔH2(CaCO3)>0
C. ΔH1(CaCO3)-ΔH1(MgCO3)=ΔH3(CaO)-ΔH3(MgO)
D. 对于MgCO3和CaCO3,ΔH1+ΔH2>ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2L的密闭容器中,一定条件下发生化学反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H= -746.4 kJ·mol-1。起始反应时 NO和CO各为 4 mol,10 秒钟后达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是( )
N2(g)+2CO2(g) △H= -746.4 kJ·mol-1。起始反应时 NO和CO各为 4 mol,10 秒钟后达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是( )
A. 反应前5秒钟内,用NO表示的平均反应速率为0.lmol·L-1·s-1
B. 达到平衡后,升髙温度,正反应速率将减小,逆反应速率将增大
C. 达到平衡后,反应速率的关系有:V正(CO)=2v逆(N2)
D. 保持容器体积不变,往容器中充入1 mol O2,正、逆反应速率都不改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com