
【题目】煤的液化可以合成甲醇。下列有关说法正确的是
①“气化”:C(s)+2H2O(g)===CO2(g)+2H2(g)ΔH1=+90.1kJ·mol—1
②催化液化I:CO2(g)+3H2(g)===CH3OH(g)+H2O(g)△H2=-49.0kJ·mol—1
③催化液化Ⅱ:CO2(g)+2H2(g)===CH3OH(g)+![]() O2(g)△H3=akJ·mol
O2(g)△H3=akJ·mol
A. 催化液化I的反应在高温下更容易自发进行
B. C(s)+H2O(g)+H2(g)==CH3OH(g)△H=+41.1kJ·mol—1
C. △H2>△H3
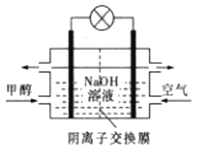
D. 如图所示为甲醇燃料电池的工作原理示意图,负极的电极反应为CH3OH-6e—+6OH—=CO2↑+5H2O
【答案】B
【解析】
A催化液化I的反应的△H<0、△S<0,则该反应在低温下能自发进行,故错误;
B.①“气化”:C(s)+2H2O(g)===CO2(g)+2H2(g)ΔH1=+90.1kJ·mol—1,②催化液化I:CO2(g)+3H2(g)===CH3OH(g)+H2O(g)△H2=-49.0kJ· mol—1,根据盖斯定律,①+②可得热化学方程式为: C(s)+H2O(g)+H2(g)=CH3OH(g) ΔH=(+90.1-49.0) kJ·mol—1=+41.1 kJ·mol—1,故正确;
C.②催化液化I:CO2(g)+3H2(g)===CH3OH(g)+H2O(g)△H2=-49.0kJ· mol—1,③催化液化Ⅱ:CO2(g)+2H2(g)===CH3OH(g)+![]() O2(g) △H3=akJ·mol—1,根据盖斯定律,②-③可得热化学方程式为:H2(g)+
O2(g) △H3=akJ·mol—1,根据盖斯定律,②-③可得热化学方程式为:H2(g)+![]() O2(g)=H2O(g) ΔH=△H2-△H3=(-49.0-a) kJ·mol—1,该反应为放热反应,即△H<0,则有△H2-△H3<0,即△H2<△H3,故错误;
O2(g)=H2O(g) ΔH=△H2-△H3=(-49.0-a) kJ·mol—1,该反应为放热反应,即△H<0,则有△H2-△H3<0,即△H2<△H3,故错误;
D.如图为甲醇燃料电池的工作原理示意图,负极的电极反应为CH3OH-6e-+8OH-=CO32-+6H2O,故错误;
故选B。


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
【题目】配合物乙二胺四乙酸铁钠( SaFeY)可溶于水,常见于铁强化盐中,回答下列问题:
实验1 制备乙二胺四乙酸铁钠晶体
实验原理:2Fe(OH)3+Na2CO3+2H4Y===2[NaFeY·3H2O]+CO2↑+H2O
实验步骤:①称取2.7 g FeCl3·6H2O于烧杯中溶解,分批次加入适量浓氨水,搅拌,过滤,洗涤,干燥。②将Fe(OH)3、乙二胺四乙酸(H4Y)、H2O加入三颈烧瓶(装置如下图),搅拌,80℃水浴反应1h,用Na2CO3溶液调节pH,经过一系列操作,过滤洗涤,晾干得到产品。

(1)“步骤①”为避免Fe(OH)3沉淀中裹入过多杂质,采取的措施有___________。
(2)判断“步骤①”中沉淀是否洗涤干净的操作为___________。
(3)若滴液漏斗替换为分液漏斗,实验中Na2CO3溶液将无法顺利滴下,其原因为___________。
(4)“步骤②”中的“一系列操作”为___________(填标号),若将溶液直接蒸干,会造成___________。
A.蒸发浓缩,趁热结晶
B.蒸发浓缩至溶液表面出现晶膜,停止加热
C蒸发浓缩至大量晶体析出,停止加热
实验2市售铁强化盐中铁含量测定
已知:①铁强化盐含有NaCl、KIO3 、NaFeY,其中n(KIO3)︰n( NaFeY)=1︰50
②I2+2S2O32-===2I-+ S4O62-
称取mg样品,加稀硫酸溶解后配成100mL溶液。取出10mL,加入稍过量的KI溶液,充分反应后,滴入淀粉溶液,用cmol·L-1Na2S2O3标准液滴定,重复操作2~3次,消耗Na2S2O3标准液平均值为VmL。
(5)I-除了与Fe3+反应外,还可发生的反应的离子方程式为___________。
(6)滴定终点的现象为___________填颜色变化)。
(7)样品中铁元素的质量分数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,能长时间保持稳定的放电电压。其电池总反应为:3Zn + 2K2FeO4 + 8H2O![]() 3Zn(OH)2 + 2Fe(OH)3 + 4KOH,下列叙述不正确的是
3Zn(OH)2 + 2Fe(OH)3 + 4KOH,下列叙述不正确的是
A. 放电时负极反应为:Zn-2e-+2OH-= Zn(OH)2
B. 充电时阳极发生氧化反应,附近溶液碱性增强
C. 充电时每转移3mol电子,阴极有1.5molZn生成
D. 放电时正极反应为:FeO42- + 3e- + 4H2O = Fe(OH)3 + 5OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,11.2 L氯气所含有的原子数目为NA
B.9 g水所含有的氢原子数目为NA
C.在同温同压时, 相同物质的量的任何气体的体积相同且为11.2L
D.1 mol NH4+ 所含质子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.氯及其化合物在工业生产中有广泛应用。
稀硝酸与活泼金属M反应制备二价金属硝酸盐,当反应物之比m(HNO3):n(M)=5:2时,还原产物为_________(填化学式)。
II.工业废气、汽车尾气中含有的NOx、SO2等,是形成雾霾的主要物质,其综合治理是当前重要的研究课题。
(一)NOx的消除
汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可发生反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g)△H。
N2(g)+2CO2(g)△H。
(1)已知:CO的燃烧热△H1=-283.0kJ·mol-1,N2(g)+O2(g)![]() 2NO(g)△H2=+180.5kJ·mol,则上述反应的△H=_______
2NO(g)△H2=+180.5kJ·mol,则上述反应的△H=_______
(2)某研究小组探究催化剂对CO、NO转化的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中的NO含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如图所示。

①下列说法正确的是_______(填字、母代号)。
A.两种催化剂均能降低反应的活化能,但反应的△H不变
B.相同条件下,改变压强对脱氮率没有影响
C.曲线Ⅱ中的催化剂适用于450℃左右脱氮
D.曲线Ⅱ中催化剂脱氮率比曲线Ⅰ中催化剂的高
②若温度低于200℃,图中曲线脱氯率随温度升高而变化不大的主要原因是__________;
判断a点对应的脱氮率是否为对应温度下的平衡脱氮率,并说明其理由:____________。
(二)SO2的综合利用
(3)某研究小组对反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)△H<0进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[n0(NO2):n0(SO2)]进行多组实验(各次实验的温度可能相同,也可能不同),测定NO的平衡转化率[a(NO2)]。部分实验结果如下图所示。
SO3(g)+NO(g)△H<0进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[n0(NO2):n0(SO2)]进行多组实验(各次实验的温度可能相同,也可能不同),测定NO的平衡转化率[a(NO2)]。部分实验结果如下图所示。

图中C、D两点对应的实验温度分别为TC和TD,通过计算判断:TC______TD(填“>”“=”或“<”)。
(4)已知25℃时,NH3H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0molL-1,将SO2通入该氨水中,当溶液呈中性时,溶液中的![]() ______
______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以![]() 表示阿伏加德罗常数,下列说法中正确的是
表示阿伏加德罗常数,下列说法中正确的是
A.58.5 g氯化钠固体中含有![]() 个氯化钠分子
个氯化钠分子
B.1 mol Fe参与反应失去电子数目一定为2![]()
C.1 molNa被完全氧化生成Na202,失去2![]() 个电子
个电子
D.常温下,46 g N02和N204的混合物中含有的氮原子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
铜、银和金是日常生活中常用金属
(1)基态铜原子的价层电子排布式为___________.
(2)银氨溶液主要成分是[Ag(NH3)2]OH,配制方法是,向AgNO3溶液中滴加氨水至沉淀刚好完全溶解为止,得到澄清的银氨溶液
①AgNO3中阴离子的空间构型是_______________;
②[Ag(NH3)2]+中银离子的配位数为___________;NH3分子中N的杂化类型是__________。
③与NH3互为等电子体的离子有:_____________。
(3)现代工业冶金中,2Au(CN)2-+Zn====2Au+Zn(CN)42-。CN-是常见的配体,提供孤电子对是C不是N,其主要原因是_________________________________。
(4)铜、银是有机反应常见的催化剂如 CH3CH2OH ![]() CH3CHO+H2↑。CH3CH2OH的沸点高于CH3CHO的主要原因是________;从原子轨道重叠方式分类,H2分子中σ键类型是____________。
CH3CHO+H2↑。CH3CH2OH的沸点高于CH3CHO的主要原因是________;从原子轨道重叠方式分类,H2分子中σ键类型是____________。
(5)一种铜镍合金(俗称白铜)的晶胞如图1所示,铜、镍原子个数比为___________。

(6)金晶胞如图2所示,这种晶体堆积方式称为___________堆积。该晶胞中原子空间利用率(![]() )为___________ (用π含的式子表示),(提示原子空间利用率=
)为___________ (用π含的式子表示),(提示原子空间利用率=![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将pH均为2 的HCl与HX 的溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。下列说法不正确的是 ( )

A. 稀释前,c(HX) > 0.01mol/L
B. 溶液的导电性: a < b
C. a、b两点:c(X-) < c(Cl-)
D. 溶液体积稀释到10倍,HX溶液的pH < 3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com