
【题目】下列气态氢化物最稳定的是( )
A. SiH4B. PH3C. H2SD. HCl
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图中A是制取溴苯的实验装置,B、C是改进后的装置,请仔细分析,对比三个装置,回答以下问题:

(1)写出三个装置中所共同发生的两个反应的化学方程式:____;_____。
(2)装置A和C均采用了长玻璃导管,其作用是____,_____。
(3)在按装置B、C装好仪器及药品后要使反应开始,应对装置B进行的操作是____;应对装置C进行的操作是____。
(4)装置B、C较好地解决了A中加装药品和使装置及时密封的矛盾,方便了操作。A装置中这一问题在实验中造成的后果是____。
(5)B中采用了洗气瓶吸收装置,其作用是___,反应后洗气瓶中可能出现的现象是______。
(6)B装置也存在两个明显的缺点,使实验的效果不好或不能正常进行。这两个缺点是____,____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铜银合金(含少量铁)废料为原料回收银和铜的工艺流程如下:

下列说法正确的是
A. 粗铜溶于过量稀硝酸,过滤、低温干燥得纯铜
B. 电解时用粗银作阴极,硝酸银溶液为电解质溶液
C. 用稀硫酸处理渣料时主要发生了氧化还原反应
D. 从滤液B中可以提取绿矾(FeSO4·7H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,二氧化硫与氧气反应的热化学方程式为2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196 kJ·mol-1。现向5 L的恒容密闭容器中充入1.0 mol SO2和0.5 mol O2气体,反应一段时间后达到平衡,恢复到原温度,测得此过程中体系向外界共释放了78.4 kJ的热量。下列说法正确的是 ( )
2SO3(g) ΔH=-196 kJ·mol-1。现向5 L的恒容密闭容器中充入1.0 mol SO2和0.5 mol O2气体,反应一段时间后达到平衡,恢复到原温度,测得此过程中体系向外界共释放了78.4 kJ的热量。下列说法正确的是 ( )
A. 上述反应达到平衡时,二氧化硫和氧气的转化率都是20%
B. 上述反应达到平衡后,向容器中充入1.0 mol Ar,平衡正向移动
C. 起始时向容器中充入1.0 mol SO3,保持温度不变,达到平衡时共吸收19.6 kJ的热量
D. 起始时向容器中充入2.0 mol SO3、0.5 mol SO2和0.25 mol O2,反应达到平衡前v正<v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸为二元弱酸:H2C2O4![]() HC2O4﹣+ H+ Ka1 ; HC2O4﹣
HC2O4﹣+ H+ Ka1 ; HC2O4﹣![]() C2O42﹣+H+ Ka2,T℃常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4﹣、C2O42﹣三种,微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是
C2O42﹣+H+ Ka2,T℃常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4﹣、C2O42﹣三种,微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是

A. T℃时,lgKa2=-4.2
B. pH=1.2溶液中:c(K+)+c(H+)=c(OH﹣)+c(H2C2O4)
C. pH=2.7溶液中:![]()
D. 向pH=1.2的溶液中再加KOH溶液,将pH增大至4.2的过程中水的电离度一直增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的液化可以合成甲醇。下列有关说法正确的是
①“气化”:C(s)+2H2O(g)===CO2(g)+2H2(g)ΔH1=+90.1kJ·mol—1
②催化液化I:CO2(g)+3H2(g)===CH3OH(g)+H2O(g)△H2=-49.0kJ·mol—1
③催化液化Ⅱ:CO2(g)+2H2(g)===CH3OH(g)+![]() O2(g)△H3=akJ·mol
O2(g)△H3=akJ·mol
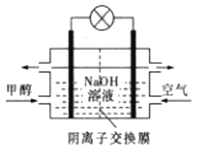
A. 催化液化I的反应在高温下更容易自发进行
B. C(s)+H2O(g)+H2(g)==CH3OH(g)△H=+41.1kJ·mol—1
C. △H2>△H3
D. 如图所示为甲醇燃料电池的工作原理示意图,负极的电极反应为CH3OH-6e—+6OH—=CO2↑+5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组设计实验探究铜的常见化学性质,过程设计如下所示
(提出猜想)
问题1:在周期表中,铜与铝的位置很靠近,铜不如铝活泼,氢氧化铝具有两性。那么,氢氧化铜也具有两性吗?
问题2:铁和铜都有变价,一般情况下,正二价铁的稳定性小于正三价铁的稳定性。那么,正一价铜的稳定性也小于正二价铜的稳定性吗?
问题3:氧化铜具有氧化性,能被H2、CO还原。那么,氧化铜也能被氮的某种气态氢化物还原吗?
(实验探究)
I.解决问题1
(1)需用到的药品除1mol L-1 CuSO4溶液、稀硫酸外,还需_________(填试剂的化学式)溶液。
(2)用胆矾晶体配制1molL-1 CuSO4溶液250mL,选用的仪器除烧杯、托盘天平、药匙、玻璃棒、胶头滴管、量简外,还有________(填仪器名称)。
(3)为达到实验目的,你认为应进行哪些相关实验?
实验内容和步骤:①_________;②_______________。
Ⅱ.解决问题2
取一定量制得的氢氧化铜固体,于坩埚中灼烧,当温度达到80~100℃时得到黑色固体粉末;继续加热至1000℃以上,黑色粉末全部变成红色粉末氧化亚铜;取适量红色氧化亚铜粉末于洁浄试管中,加入过量的稀硫酸(或盐酸),得到蓝色溶液,同时观察到试管底部还有红色固体存在。根据以上实验现象回答冋题:
(1)写出氧化亚铜与稀硫酸(或盐酸)反应的离子方程式:_____________。
(2)从实验Ⅱ可得出的结论是_______________________。
Ⅲ.解决问题3
设计如下装置(夹持装置未画出):

当氮的某种气态氢化物(X)缓缓通过灼热的氧化铜时,观察到氧化铜由黑色变成了红色,无水CuSO4变成了蓝色,生成物中还有一种无污染的单质气体Y;将X通入灼热的CuO燃烧管完全反应后,消耗0.01molX,测得B装置增重0.36g,并收集到0.28g单质气体Y。
(1)X气体的摩尔质量是_________________。
(2)C装置中发生反应的化学方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖的结构简式为CH2OH-CHOH-CHOH-CHOH-CHOH-CHO,其对应的性质中不正确的是( )
A.与钠反应放出氢气B.可与乙酸发生酯化反应
C.能发生银镜反应D.可与小苏打溶液反应,产生气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业的原理改进方法如图分两个阶段进行,下列说法中错误的是( )

A. 在阶段I中,电源a为正极、b为负极
B. 阶段Ⅱ阴极反应:Na0.44-xMnO2+xe-+xNa+=Na0.44MnO2
C. 比传统氯碱工业减少了阳离子交换膜,避免氢气和氯气混合,便于NaOH提纯
D. 阶段Ⅰ,Ⅱ的反应不能都在饱和食盐水的条件下进行
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com