
【题目】I.氯及其化合物在工业生产中有广泛应用。
稀硝酸与活泼金属M反应制备二价金属硝酸盐,当反应物之比m(HNO3):n(M)=5:2时,还原产物为_________(填化学式)。
II.工业废气、汽车尾气中含有的NOx、SO2等,是形成雾霾的主要物质,其综合治理是当前重要的研究课题。
(一)NOx的消除
汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可发生反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g)△H。
N2(g)+2CO2(g)△H。
(1)已知:CO的燃烧热△H1=-283.0kJ·mol-1,N2(g)+O2(g)![]() 2NO(g)△H2=+180.5kJ·mol,则上述反应的△H=_______
2NO(g)△H2=+180.5kJ·mol,则上述反应的△H=_______
(2)某研究小组探究催化剂对CO、NO转化的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中的NO含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如图所示。

①下列说法正确的是_______(填字、母代号)。
A.两种催化剂均能降低反应的活化能,但反应的△H不变
B.相同条件下,改变压强对脱氮率没有影响
C.曲线Ⅱ中的催化剂适用于450℃左右脱氮
D.曲线Ⅱ中催化剂脱氮率比曲线Ⅰ中催化剂的高
②若温度低于200℃,图中曲线脱氯率随温度升高而变化不大的主要原因是__________;
判断a点对应的脱氮率是否为对应温度下的平衡脱氮率,并说明其理由:____________。
(二)SO2的综合利用
(3)某研究小组对反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)△H<0进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[n0(NO2):n0(SO2)]进行多组实验(各次实验的温度可能相同,也可能不同),测定NO的平衡转化率[a(NO2)]。部分实验结果如下图所示。
SO3(g)+NO(g)△H<0进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[n0(NO2):n0(SO2)]进行多组实验(各次实验的温度可能相同,也可能不同),测定NO的平衡转化率[a(NO2)]。部分实验结果如下图所示。

图中C、D两点对应的实验温度分别为TC和TD,通过计算判断:TC______TD(填“>”“=”或“<”)。
(4)已知25℃时,NH3H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0molL-1,将SO2通入该氨水中,当溶液呈中性时,溶液中的![]() ______
______
【答案】NH4NO3或N2O -746.5kJ·mol-1 A、C 温度较低时,催化剂的活性偏低 不是平衡脱氮率,因为该反应为放热反应,根据曲线Ⅱ可知,a点对应温度的平衡脱氮率应该更高 = 2.24
【解析】
I.根据硝酸与金属反应,产物与硝酸的浓度、金属的活泼性有关;分两种情况讨论:再根据得失电子守恒得出答案;
II.(1)根据CO的燃烧热,利用盖斯定律求解;
(2)①根据影响化学反应速率及化学平衡的因素求解;②根据曲线Ⅱ描述的内容解答;
(3)根据NO2的平衡转化率结合“三段式”计算,再根据平衡常数只与温度有关得出答案;
(4)根据电荷守恒,利用当溶液呈中性时c(H+)=c(OH-)求解。
I.硝酸与金属反应,产物与硝酸的浓度、金属的活泼性有关。若硝酸为10mol,金属M为4mol,则生成了4mol M(NO3)2,还原产物中含2mol N原子。分两种情况讨论:根据得失电子守恒,如果只有1nol氮的化合价降低,则由+5降至-3,还原产物为NH4NO3;如果2mol氮的化合价都降低,则由+5降至+1,还原产物为N2O,故答案为:NH4NO3
或N2O
II.(1)根据CO燃烧热的△H1=-283.0kJ·mol-1,可得到CO燃烧的热化学方程式为①CO(g)+![]() O2(g)=CO2(g) △H1=-283.0kJ·mol-1,②N2(g)+O2(g)
O2(g)=CO2(g) △H1=-283.0kJ·mol-1,②N2(g)+O2(g)![]() 2NO(g)△H2=+180.5kJ·mol-1,根据盖斯定律,由①x2-②得2NO(g)+2CO(g)
2NO(g)△H2=+180.5kJ·mol-1,根据盖斯定律,由①x2-②得2NO(g)+2CO(g)![]() N2(g)+2CO2(g)的△H=(-283.0kJ·mol-1)×2-(+180.5kJ·mol-1)=-746.5kJ·mol-1,故答案为:-746.5kJ·mol-1
N2(g)+2CO2(g)的△H=(-283.0kJ·mol-1)×2-(+180.5kJ·mol-1)=-746.5kJ·mol-1,故答案为:-746.5kJ·mol-1
(2)①两种催化剂均能降低反应的活化能,加快化学反应速率,但不改变反应的△H,A正确;该反应的正反应为气体分子数减小的反应,增大压强平衡向正反应方向移动,脱氮率增大,B错误;观察图象,曲线Ⅱ在450℃左右催化活性最大,曲线Ⅱ中的催化剂适用于450℃左右脱氮,C正确;催化剂只影响化学反应速率,不改变化学平衡,不影响脱氮率,D错误,答案为:A、C;
②温度若低于200℃,催化剂的活性偏低,对化学反应速率的影响比较小;该反应的正反应为放热反应,降低温度平衡正向移动,脱氮率增大,根据曲线Ⅱ可知,a点对应温度下的平衡脱氮率应高于450℃时曲线Ⅱ对应的脱氮率。故答案为:温度较低时,催化剂的活性偏低;不是平衡脱氮率,因为该反应为放热反应,根据曲线Ⅱ可知,a点对应温度的平衡脱氮率应该更高;
(3)C点,原料气配比为1,设c(NO2)=c(SO2)=1mol·L-1,NO2的平衡转化率为50%,根据“三段式”有:
NO2(g)+SO2(g)![]() SO3(g)+NO(g)
SO3(g)+NO(g)
起始浓度(mol·L-1):1 1 0 0
转化浓度(mol·L-1):1×50% 0.5 0.5 0.5
平衡浓度(mol·L-1):0.5 0.5 0.5 0.5
化学平衡常数Kc=![]() ;
;
D点,原料气配比为1.5,设c(NO2)=1.5mol·L-1,c(SO2)=1mol·L-1,NO2的平衡转化率为40%,根据“三段式”有:NO2(g)+SO2(g)![]() SO3(g)+NO(g)
SO3(g)+NO(g)
起始浓度(mol·L-1): 1.5 1 0 0
转化浓度(mol·L-): 1.5×40% 0.6 0.6 0.6
平衡浓度(mol·L-1): 0.9 0.4 0.6 0.6
化学平衡常数KD=![]() ;
;
KC=KD,根据平衡常数只与温度有关,则TC=TD,故答案为:=
(4)NH3·H2O的电离方程式为NH3·H2O![]() NH4++OH-,SO2通入氨水中,根据电荷守恒有c(NH4+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-),当溶液呈中性时c(H+)=c(OH-),则c(NH4+)=c(HSO3-)+2c(SO32-),Ka2=
NH4++OH-,SO2通入氨水中,根据电荷守恒有c(NH4+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-),当溶液呈中性时c(H+)=c(OH-),则c(NH4+)=c(HSO3-)+2c(SO32-),Ka2=![]() ,c(SO32-)=
,c(SO32-)=![]() ,c(NH4+)=c(HSO3-)+2×
,c(NH4+)=c(HSO3-)+2×![]() = c(HSO3-) ×
= c(HSO3-) ×![]() ,
,![]() =
=![]() ,故答案为:2.24。
,故答案为:2.24。


科目:高中化学 来源: 题型:
【题目】糖类、油脂、蛋白质是人类生活的基本营养物质,下列叙述不正确的是
A.葡萄糖是单糖B.淀粉是糖类物质,它遇碘化钾迅速变蓝
C.蛋白质烧焦时可产生特殊气味D.油脂在碱性条件下水解可以制肥皂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I2在KI溶液中存在平衡I2(aq)+I(aq)=I3—(aq)。某I2、KI混合溶液中,I3—的物质的量浓度c(I3—)与温度T的关系如图所示(曲线上的任何点都表示平衡状态)。下列说法正确的是

①I2(aq)+I—(aq)=I3—(ag) ΔH>0
②若温度为T1、T2时反应的平衡常数分别为K1、K2,则K1>K2
③若反应进行到状态D时,一定有v正>v逆
④状态A与状态B相比,状态A的c(I2)大
⑤保持温度不变,向该混合溶液中加水,![]() 将变大
将变大
A. 只有①②B. 只有②③C. ①③④D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+ 5O2(g)![]() 4NO(g)+ 6H2O(g),下列叙述正确的是
4NO(g)+ 6H2O(g),下列叙述正确的是
A. 达到化学平衡时,4υ正(O2)= 5υ逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
C. 达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
D. 化学反应速率关系是:2υ正(NH3)= 3υ正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的液化可以合成甲醇。下列有关说法正确的是
①“气化”:C(s)+2H2O(g)===CO2(g)+2H2(g)ΔH1=+90.1kJ·mol—1
②催化液化I:CO2(g)+3H2(g)===CH3OH(g)+H2O(g)△H2=-49.0kJ·mol—1
③催化液化Ⅱ:CO2(g)+2H2(g)===CH3OH(g)+![]() O2(g)△H3=akJ·mol
O2(g)△H3=akJ·mol
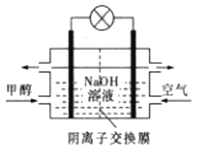
A. 催化液化I的反应在高温下更容易自发进行
B. C(s)+H2O(g)+H2(g)==CH3OH(g)△H=+41.1kJ·mol—1
C. △H2>△H3
D. 如图所示为甲醇燃料电池的工作原理示意图,负极的电极反应为CH3OH-6e—+6OH—=CO2↑+5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按如下图所示步骤进行操作(注意事项:①所加试剂必须过量;②过量试剂必须除去;③不能引入新的杂质)。

回答下列问题:
(1)试剂Ⅰ的化学式为_______,
(2)试剂Ⅱ的化学式为______,②中加入试剂Ⅱ的目的是_____。
(3)试剂Ⅲ的名称是_________,③中发生反应的化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应,N2O4(g)![]() 2NO2(g) ΔH>0,现将1 mol N2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是
2NO2(g) ΔH>0,现将1 mol N2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是

A. ab B. bc C. ac D. ad
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CO(g)+O2(g)=2CO2(g)ΔH=-566kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+![]() O2(g)ΔH=-226kJ/mol
O2(g)ΔH=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是
A. CO的燃烧热为283 kJ
B. 如图可表示由CO生成CO2的反应过程和能量关系
C. 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol
D. CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(乙二酸)存在于自然界的植物中,草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。
回答下列问题:
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物。

若草酸晶体分解的产物中有CO2,则装置C中可观察到的现象是_____________________,装置B的主要作用是____________________________________。
(2)乙组同学认为草酸晶体分解产物除CO2外还有CO,为进一步验证CO的存在,选用甲组实验中的装置A、B和下图所示部分装置(可以重复选用)进行实验,装置G干燥管中装有的无水氯化钙是干燥剂,可以除去气体中的水分。



①乙组同学的实验装置中,依次连接的合理顺序为A、B、__________________。装置H硬质玻璃管中盛有的物质是______________________。
②能证明草酸晶体分解产物中有CO的现象是____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com