
【题目】氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按如下图所示步骤进行操作(注意事项:①所加试剂必须过量;②过量试剂必须除去;③不能引入新的杂质)。

回答下列问题:
(1)试剂Ⅰ的化学式为_______,
(2)试剂Ⅱ的化学式为______,②中加入试剂Ⅱ的目的是_____。
(3)试剂Ⅲ的名称是_________,③中发生反应的化学方程式为__________。
【答案】BaCl2 K2CO3 加入碳酸钾的目的是除去多余的Ba2+ 盐酸 2HCl+K2CO3=2KCl+CO2↑+H2O
【解析】
提纯氯化钾,除去SO42-、CO32-需要加入过量的BaCl2,过量的BaCl2需要加入碳酸钾除去,过量的K2CO3需要加入盐酸,据此分析;
提纯氯化钾,氯化钾中含有的杂质是K2CO3、K2SO4,除去SO42-、CO32-需要加入BaCl2溶液,即试剂①为BaCl2,得到BaSO4、BaCO3沉淀和KCl、BaCl2滤液,然后过滤,用K2CO3除去过量的BaCl2,试剂Ⅱ为K2CO3,然后为过滤,溶液D含有过量的K2CO3,需要加入HCl除去,试剂Ⅲ为盐酸,E为KCl和HCl混合液,然后蒸发结晶,得到KCl晶体;
(1)根据上述分析,试剂I为BaCl2溶液;
答案为BaCl2溶液;
(2)试剂Ⅱ为K2CO3,加入碳酸钾的目的是除去多余的Ba2+;
答案为K2CO3;加入碳酸钾的目的是除去多余的Ba2+;
(3)试剂Ⅲ为盐酸,发生的反应为2HCl+K2CO3=2KCl+CO2↑+H2O;
答案为盐酸;2HCl+K2CO3=2KCl+CO2↑+H2O。


科目:高中化学 来源: 题型:
【题目】国际计量大会第26次会议新修订了阿伏加德罗常数(NA=6.02214076×1023mol-1),并于2019年5月20日正式生效。下列说法正确的是( )
A. 56g聚乙烯分子中含碳碳双键的数目为2 NA
B. 核聚变如21H+31H―→42He+10n,由于有新微粒生成,该变化是化学变化
C. 铅蓄电池放电时负极净增质量比正极净增质量多16g时转移电子数为NA
D. 1L0.5mlol·L-1Al2Fe(SO4)4溶液中阳离子数目小于1.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) ![]() M(g)+N(g),所得实验数据如下表,下列说法不正确的是
M(g)+N(g),所得实验数据如下表,下列说法不正确的是
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(X) | n(Y) | n(M) | ||
① | 700 | 0.10 | 0.10 | 0.09 |
② | 800 | 0.20 | 0.20 | 0.10 |
③ | 900 | 0.10 | 0.15 | a |
A. 正反应为放热反应
B. 实验①中,若5min时测得n(M)=0.05mol,则0~5min时间内,用N表示的平均反应速率v(N)= 0.01mol/(Lmin)
C. 实验②中,该反应的平衡常数K=1.0
D. 实验③中,达到平衡时,a大于0.06
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对阿伏加德罗定律及推论的理解不正确的是( )
A.同温同压下,气体的体积之比等于它们的物质的量之比
B.同温同压下,气体的体积之比等于它们的质量之比
C.同温同压下,相同体积的气体质量比等于它们的相对分子质量之比
D.同温同压下,气体的密度之比等于它们的相对分子质量之比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.氯及其化合物在工业生产中有广泛应用。
稀硝酸与活泼金属M反应制备二价金属硝酸盐,当反应物之比m(HNO3):n(M)=5:2时,还原产物为_________(填化学式)。
II.工业废气、汽车尾气中含有的NOx、SO2等,是形成雾霾的主要物质,其综合治理是当前重要的研究课题。
(一)NOx的消除
汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可发生反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g)△H。
N2(g)+2CO2(g)△H。
(1)已知:CO的燃烧热△H1=-283.0kJ·mol-1,N2(g)+O2(g)![]() 2NO(g)△H2=+180.5kJ·mol,则上述反应的△H=_______
2NO(g)△H2=+180.5kJ·mol,则上述反应的△H=_______
(2)某研究小组探究催化剂对CO、NO转化的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中的NO含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如图所示。

①下列说法正确的是_______(填字、母代号)。
A.两种催化剂均能降低反应的活化能,但反应的△H不变
B.相同条件下,改变压强对脱氮率没有影响
C.曲线Ⅱ中的催化剂适用于450℃左右脱氮
D.曲线Ⅱ中催化剂脱氮率比曲线Ⅰ中催化剂的高
②若温度低于200℃,图中曲线脱氯率随温度升高而变化不大的主要原因是__________;
判断a点对应的脱氮率是否为对应温度下的平衡脱氮率,并说明其理由:____________。
(二)SO2的综合利用
(3)某研究小组对反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)△H<0进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[n0(NO2):n0(SO2)]进行多组实验(各次实验的温度可能相同,也可能不同),测定NO的平衡转化率[a(NO2)]。部分实验结果如下图所示。
SO3(g)+NO(g)△H<0进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[n0(NO2):n0(SO2)]进行多组实验(各次实验的温度可能相同,也可能不同),测定NO的平衡转化率[a(NO2)]。部分实验结果如下图所示。

图中C、D两点对应的实验温度分别为TC和TD,通过计算判断:TC______TD(填“>”“=”或“<”)。
(4)已知25℃时,NH3H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0molL-1,将SO2通入该氨水中,当溶液呈中性时,溶液中的![]() ______
______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂制备净水剂硫酸铁铵晶体[NH4Fe(SO4)2·6H2O]的一种方案如下:

下列说法不正确的是
A. 滤渣A的主要成分是CaSO4
B. 相同条件下,NH4Fe(SO4)2·6H2O净水能力比FeCl3强
C. “合成”反应要控制温,温度过高,产率会降低
D. “系列操作”包括蒸发浓缩、降温结晶、过滤、干燥等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某抗结肠炎药物的有效成分(R)的结构简式如下。下列说法不正确的是

A. R能发生加成、取代反应
B. R分子中所有C和N原子一定共平面
C. R的苯环上官能团位置异构体有10种
D. R的分子式为C7H7O3N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种用铝土矿和硫铁矿烧渣(配料中含Al2O3、Fe2O3,FeO及SiO2等)为原料制备无机高分子絮凝剂聚合碱式氯化铝铁的流程如下:
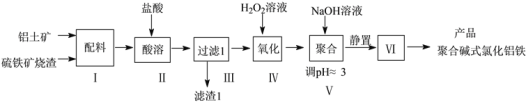
(1)步骤Ⅱ酸溶时,Fe2O3被溶解的化学程式为____,滤渣1的成分为____(填化学式)。
(2)步骤Ⅳ发生反应的离子方程式为________________。
(3)步骤V若将溶液pH调成6,可能造成的影响是_______;步骤Ⅵ包含的操作有_______。
(4)测定聚合碱式氯化铝铁{可表示为[FeaAlb(OH)xCly]n}中n(Al)/n(Fe)的比值的步骤如下:
步骤1.准确称取产品5.710g溶于水,加入足量的稀氨水,过滤,将滤渣灼烧至质量不再变化,得到3.350 g固体。
步骤2.另准确称取2.855g样品,溶于足量NaOH溶液,过滤,充分洗涤,将滤渣灼烧至质量不再变化,得到固体0.4000g。
计算产品中n(Al)/n(Fe)的比值(写出计算过程)。__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求计算并填空
(1)32gSO2标况下的体积为____________L,含有______________个氧原子。
(2)1.204×1023个NH3分子所含的氢原子数与________mol CH4含有的氢原子数相同。
(3)标况下,某CO2和H2混合气体的密度为1.25g/L,则混合气体中CO2和H2的体积比约为______________。
(4)200 mL某硫酸盐溶液中含SO42- 1.5 NA个,含金属离子NA个,则该硫酸盐溶液的物质的量浓度为________mol/L。
(5)把VmL含有Al2(SO4)3和(NH4)2SO4的混合溶液分成两等份,一份加入含足量NaOH的溶液并加热,铵根离子完全反应生成a mol NH3(已知NH4++OH-![]() NH3↑+H2O);另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中Al3+的浓度为_____________mol/L。
NH3↑+H2O);另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中Al3+的浓度为_____________mol/L。
(6)将20.0g质量分数为14.0%的 NaNO3溶液与30.0g质量分数为24.0%的NaNO3溶液混合,得到的密度为1.15g/cm3的混合溶液。混合后溶液的物质的量浓度为______(结果保留1位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com