
【题目】国际计量大会第26次会议新修订了阿伏加德罗常数(NA=6.02214076×1023mol-1),并于2019年5月20日正式生效。下列说法正确的是( )
A. 56g聚乙烯分子中含碳碳双键的数目为2 NA
B. 核聚变如21H+31H―→42He+10n,由于有新微粒生成,该变化是化学变化
C. 铅蓄电池放电时负极净增质量比正极净增质量多16g时转移电子数为NA
D. 1L0.5mlol·L-1Al2Fe(SO4)4溶液中阳离子数目小于1.5 NA
【答案】C
【解析】
A.在乙烯加聚形成聚乙烯分子时,其碳碳双键断开其中一个键而互相连接成链,所以聚乙烯中碳碳双键的数目为0,A项错误;
B.原子是化学变化中的最小微粒,原子发生变化,不属于化学研究的范畴,故核聚变不属于化学变化,B项错误;
C.铅蓄电池放电时负极Pb变为PbSO4:Pb-2e-+SO42-=PbSO4,1molPb发生反应,负极增重1molSO4,正极PbO2变为PbSO4:PbO2+4H++SO42-+2e-=PbSO4+2H2O,反应1molPbO2,正极增重1molSO2,可见该反应每转移2mole-,负极减正极的质量相差2mol氧原子质量;现正负极质量相差16g, 为1mol的氧原子质量,所以转移电子1mol,C项正确;
D.1L0.5mlol·L-1Al2Fe(SO4)4溶液中,溶质的物质的量为0.5mol,溶质处于固体状态时,其阳离子的数目为1.5mol,当其溶于水后,阳离子Fe2+和Al3+均发生水解:Al3++3H2O![]() Al(OH)3+3H+,Fe2++2H2O
Al(OH)3+3H+,Fe2++2H2O![]() Fe(OH)2+2H+,阳离子数目增加,D项错误;
Fe(OH)2+2H+,阳离子数目增加,D项错误;
所以答案选择C项。


科目:高中化学 来源: 题型:
【题目】有机物G是一种高分子化合物,常用作有机合成的中间体,并可用作乳胶漆等。可以通过以下途径合成:

已知有机物A中含有C、H、O、Cl四种元素且同一个碳原子上不直接连接两个官能团。
(1)A的结构简式为___________或___________;反应③的反应类型_____________________。
(2) 写出反应⑤和反应⑥的化学方程式:反应⑤___________;反应⑥(在一定条件下)___________。
(3)写出1种E的同系物的名称_____________________。写出1种与F含有相同官能团的F的同分异构体的结构简式_______________。
(4)试设计一条以![]() 为原料合成
为原料合成![]() 的合成路线__________________。(合成路线常用的表示方式为:甲
的合成路线__________________。(合成路线常用的表示方式为:甲![]() 乙……
乙……![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,取0.1mol·L-1HY溶液与0.1mol·L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=9,则下列说法正确的是
A. 混合溶液中由水电离出的c(OH-)=1×10-9mol/L
B. 混合溶液中离子浓度由大到小的顺序为c(Y-)﹥c(Na+)﹥c(OH-)﹥c(H+)
C. 混合溶液中c(OH-)-c(HY)= c(H+)=1×10-9mol/L
D. 混合溶液中c(Na+)=c(Y-)+c(HY)=0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是几种有机化合物的转换关系:

请回答下列问题:
(1)根据系统命名法,化合物A的名称是__________。
(2)上述框图中,①是__________反应,③是__________反应(填反应类型)。
(3)化合物E是重要的工业原料,写出由D生成E的化学方程式:______________________。
(4)C2的结构简式是_________________________________,F1的结构简式是__________________________________________,F1和F2互为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖类、油脂、蛋白质是人类生活的基本营养物质,下列叙述不正确的是
A.葡萄糖是单糖B.淀粉是糖类物质,它遇碘化钾迅速变蓝
C.蛋白质烧焦时可产生特殊气味D.油脂在碱性条件下水解可以制肥皂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,对于可逆反应:X(g)+3Y(g) ![]() 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol ·L-1,则下列判断正确的是( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol ·L-1,则下列判断正确的是( )
A. c1∶c2=1∶3
B. 平衡时Y和Z的生成速率之比为2∶3
C. X、Y的转化率之比为1:3
D. c1的取值范围为0.04 mol·L-1<c1<0.14 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向10mL0.1mol/L的HR溶液中逐滴加入0.1mol/L的氨水,所得溶液pH及导电性变化如图。下列分析正确的是

A. a~c点,溶液中离子数目先增大后减小
B. b点溶液pH=7说明c(NH4+)=c(R-)
C. c点溶液存在c(NH4+)>c(R-)>c(H+)>c(OH-)
D. b、c两点对应溶液中,水的电离程度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。回答下列问题:
(1)氮原子价层电子对的轨道表达式(电子排布图)为_____________。
(2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图(a)所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是___________;氮元素的E1呈现异常的原因是__________。
(3)经X射线衍射测得化合物R的晶体结构,其局部结构如图(b)所示。
①从结构角度分析,R中两种阳离子的相同之处为_________,不同之处为__________。(填标号)
A.中心原子的杂化轨道类型 B.中心原子的价层电子对数
C.立体结构 D.共价键类型
②R中阴离子N5-中的σ键总数为________个。分子中的大π键可用符号![]() 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为![]() ),则N5-中的大π键应表示为____________。
),则N5-中的大π键应表示为____________。
③图(b)中虚线代表氢键,其表示式为(NH4+)N-H┄Cl、____________、____________。
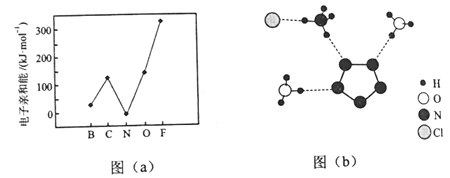
(4)R的晶体密度为d g·cm-3,其立方晶胞参数为a nm,晶胞中含有y个[(N5)6(H3O)3(NH4)4Cl]单元,该单元的相对质量为M,则y的计算表达式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按如下图所示步骤进行操作(注意事项:①所加试剂必须过量;②过量试剂必须除去;③不能引入新的杂质)。

回答下列问题:
(1)试剂Ⅰ的化学式为_______,
(2)试剂Ⅱ的化学式为______,②中加入试剂Ⅱ的目的是_____。
(3)试剂Ⅲ的名称是_________,③中发生反应的化学方程式为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com