
【题目】
铜、银和金是日常生活中常用金属
(1)基态铜原子的价层电子排布式为___________.
(2)银氨溶液主要成分是[Ag(NH3)2]OH,配制方法是,向AgNO3溶液中滴加氨水至沉淀刚好完全溶解为止,得到澄清的银氨溶液
①AgNO3中阴离子的空间构型是_______________;
②[Ag(NH3)2]+中银离子的配位数为___________;NH3分子中N的杂化类型是__________。
③与NH3互为等电子体的离子有:_____________。
(3)现代工业冶金中,2Au(CN)2-+Zn====2Au+Zn(CN)42-。CN-是常见的配体,提供孤电子对是C不是N,其主要原因是_________________________________。
(4)铜、银是有机反应常见的催化剂如 CH3CH2OH ![]() CH3CHO+H2↑。CH3CH2OH的沸点高于CH3CHO的主要原因是________;从原子轨道重叠方式分类,H2分子中σ键类型是____________。
CH3CHO+H2↑。CH3CH2OH的沸点高于CH3CHO的主要原因是________;从原子轨道重叠方式分类,H2分子中σ键类型是____________。
(5)一种铜镍合金(俗称白铜)的晶胞如图1所示,铜、镍原子个数比为___________。

(6)金晶胞如图2所示,这种晶体堆积方式称为___________堆积。该晶胞中原子空间利用率(![]() )为___________ (用π含的式子表示),(提示原子空间利用率=
)为___________ (用π含的式子表示),(提示原子空间利用率=![]() )
)
【答案】3d104s1 平面三角形 2 sp3 H3O+ C的电负性比N小,吸引孤电子对的能力比N弱 乙醇分子间形成氢键 s-s 3:1 面心立方最密 ![]()
【解析】
(1)铜原子有29个电子,电子排布要遵循洪特规则的特例。
(2)①NO3-形成3个σ键,或价层电子对为3+(6-2×3)/2=3;
②配位数等于配位原子个数,NH3中N原子是配位原子;[Ag(NH3)2]+中银离子的配位数为2;NH3分子中N的杂化类型是sp3杂化。
③等电子体原子个数和价电子总数相同。
(3)提供孤电子对形成配位键具备两个条件,一是有孤电子对,二是配位原子的电负性不能太大;
(4)CH3CH2OH的沸点高于CH3CHO的主要原因是CH3CH2OH的分子间形成氢键;从原子轨道重叠方式分类,H2分子中σ键类型是s-s键。
(5)用均摊法分析;
(6)利用公式原子空间利用率=![]()
(1)铜原子有29个电子,电子排布要遵循洪特规则的特例。基态铜原子的价层电子排布式为3d104s1;
(2)①NO3-形成3个σ键,或价层电子对为3+(6-2×3)/2=3,故空间构型为平面三角形。
②配位数等于配位原子个数,NH3中N原子是配位原子;[Ag(NH3)2]+中银离子的配位数为2;NH3分子中N的杂化类型是sp3杂化。
③等电子体原子个数和价电子总数相同,与NH3互为等电子体的离子有:H3O+。
(3)提供孤电子对形成配位键具备两个条件,一是有孤电子对,二是配位原子的电负性不能太大,如CO、CN-等配体中C提供孤电子对,因为C的电负性比N、O的小。
(4)H2中H与H原子只有σs-s键。
(5)面心立方中,顶点贡献率为1/8,面心贡献率为1/4,一个晶胞含3个铜原子、1个镍原子,因此铜、镍原子个数比为3:1。
(6)设金原子半径为r,晶胞参数为a。面心立方晶胞中,面对角线上3个金原子相切,有:(4r)2=2a2,r=![]() a,1个金晶胞含4个金原子,
a,1个金晶胞含4个金原子,![]() =
=![]()


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】G是药物合成中的一种重要中间体,下面是G的一种合成路线:
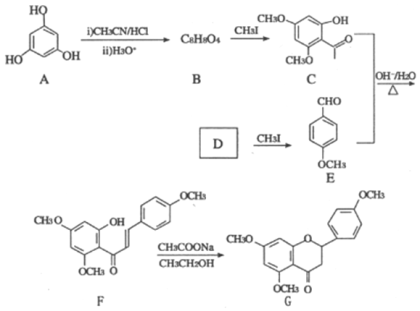
回答下列问题:
(1)B的结构简式为__________,其中所含官能团的名称为__________;B生成C的反应类型为__________。
(2)D的名称是__________。
(3)由C和E合成F的化学方程式为________________________________________。
(4)D的同分异构体中,能发生银镜反应且分子结构中含苯环的还有__________种,其中核磁共振氢谱上有6组峰,峰面积之比为1∶1∶1∶1∶1∶1的同分异构体的结构简式为______________________ (一种即可)。
(5)参照上述合成路线,以CH3CH2Cl为原料(其他试剂任选),设计制备巴豆醛(CH3CH=CH
CHO)的合成路线。_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的液化可以合成甲醇。下列有关说法正确的是
①“气化”:C(s)+2H2O(g)===CO2(g)+2H2(g)ΔH1=+90.1kJ·mol—1
②催化液化I:CO2(g)+3H2(g)===CH3OH(g)+H2O(g)△H2=-49.0kJ·mol—1
③催化液化Ⅱ:CO2(g)+2H2(g)===CH3OH(g)+![]() O2(g)△H3=akJ·mol
O2(g)△H3=akJ·mol
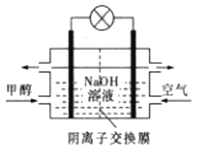
A. 催化液化I的反应在高温下更容易自发进行
B. C(s)+H2O(g)+H2(g)==CH3OH(g)△H=+41.1kJ·mol—1
C. △H2>△H3
D. 如图所示为甲醇燃料电池的工作原理示意图,负极的电极反应为CH3OH-6e—+6OH—=CO2↑+5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应,N2O4(g)![]() 2NO2(g) ΔH>0,现将1 mol N2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是
2NO2(g) ΔH>0,现将1 mol N2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是

A. ab B. bc C. ac D. ad
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖的结构简式为CH2OH-CHOH-CHOH-CHOH-CHOH-CHO,其对应的性质中不正确的是( )
A.与钠反应放出氢气B.可与乙酸发生酯化反应
C.能发生银镜反应D.可与小苏打溶液反应,产生气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CO(g)+O2(g)=2CO2(g)ΔH=-566kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+![]() O2(g)ΔH=-226kJ/mol
O2(g)ΔH=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是
A. CO的燃烧热为283 kJ
B. 如图可表示由CO生成CO2的反应过程和能量关系
C. 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol
D. CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.需要加热才能发生的反应一定是吸热反应
B.放热反应在常温下一定很容易发生
C.化学反应中的能量变化主要是由化学键变化引起的
D.化学反应中能量变化的大小与反应物的质量多少无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中,正确的是
A.镁合金的硬度、强度、熔点均高于纯镁
B.我国流通的硬币材质是纯金属
C.湿法炼铜过程中发生了置换反应
D.明矾能净水,主要原因是其在溶液中形成的Al(OH)3胶体能消毒、杀菌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图可以从不同角度研究含铁物质的性质及其转化关系。图中甲~己均含铁元素。回答下列问题:

(1)K2FeO4常用作杀菌消毒剂,从铁元素化合价的角度分析是因其具有____性;下列关于乙的说法正确的是______(填标号)。
a.属于酸性氧化物,能与碱反应
b.属于碱性氧化物,能与酸反应
c.属于两性氧化物,既能与酸反应,又能与碱反应
(2)已知甲与稀硝酸反应的化学方程式为甲+HNO3―→戊+己+NO↑+H2O(方程式未配平)。若产物中戊和己的物质的量之比为3∶1,则甲与HNO3的物质的量之比为____。
(3)戊与烧碱溶液反应生成丙,放置一段时间后丙转化为丁,丙转化为丁的化学方程式为______,现象为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com